题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,用途十分广泛。它可以作净水剂,在无机化学工业中,它是制取其它铁化合物的原料。
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
【实验探究】某化学小组选用下图所示部分装置进行实验(部分夹持装置略)
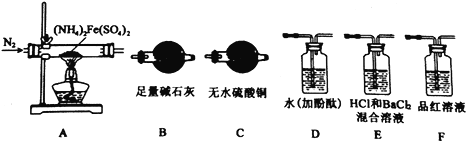
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为(________)。
A.A-B-C-D B.A-C-B-D C.A-D-B-C D.A-D-C-B
②取A中残留固体,加入适量稀硫酸,使其完全溶解得到溶液B,下列哪组实验能够证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4(________)
A.向溶液B中滴加酸性高锰酸钾溶液,高锰酸钾溶液不褪色
B.向溶液B中加入苯酚,溶液呈紫色
C.向溶液B中通入足量氯气,加入硫氰酸钾溶液变红色
D.向溶液B中加入铁氰化钾溶液,无现象
(2)探究分解产物中的硫氧化物,连接装置A—E—F—B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出该硫化物是__________。
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式________。
【答案】 B AD SO2 2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O
【解析】(1)①验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁的氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中还有氨气,因此所选用装置的正确连接顺序为A-C-B-D,答案选B;②根据亚铁离子具有还原性可以使酸性高锰酸钾溶液褪色设计或利用铁氰化钾检验,即向溶液B中滴加酸性高锰酸钾溶液,高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4,或向溶液B中加入铁氰化钾溶液,无现象,答案选AD;(2)①E中为含HCl的BaCl2溶液没有明显现象,说明没有硫酸钡沉淀生成,证明分解产物中无三氧化硫生成,二氧化硫具有漂白性能使品红溶液褪色,F中溶液褪色说明有二氧化硫生成;②实验证明(NH4)2Fe(SO4)2受热分解生成氨气、二氧化硫、氧化铁、水,还有N2产生,结合原子守恒和电子守恒配平该反应的化学方程式为2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O。
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案