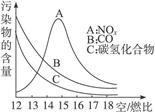
题目内容
(1)按反应理论值,SO2和O2的物质的量之比为2∶1,经过初步处理的废气中,SO2与O2的物质的量的比值为_________________,采用这样比值的原因是_________________。
(2)由计算说明为什么废气以5 m3/h速度与20 L/h速率的NH3混合?
(1)1∶50 增大O2的浓度,提高SO2的转化率
(2)v(NH3)∶v(SO2)=2∶1时,SO2可全部转化为(NH4)2SO4。
(2)v(NH3)∶v(SO2)=2∶1时,SO2可全部转化为(NH4)2SO4。
(1)废气中含SO2 0.2%,O2 10%(体积分数),则相当于体积比2∶100,即1∶50,采用这样比值的原因是增大O2的浓度,提高了SO2的转化率。
(2)废气中每小时排放SO2为:
1000 L/m3×5 m3/h×0.2%="10" L/h
氨气与SO2气体的速度比值为:v(NH3)∶v(SO2)=2∶1,则NH3与SO2完全转化为(NH4)2SO4。
(2)废气中每小时排放SO2为:
1000 L/m3×5 m3/h×0.2%="10" L/h
氨气与SO2气体的速度比值为:v(NH3)∶v(SO2)=2∶1,则NH3与SO2完全转化为(NH4)2SO4。

练习册系列答案
相关题目