��Ŀ����
����Ŀ���ش����и��⣺
��1����H2��H2����H2O��H2O����CH3OH��H2O����CCl4��H2O���������Է���֮��ֻ���ڷ��»������� �� �������������(�����)
��2�������ʢٱ�����NH3����C3H8����  ���ݶ��ǻ�����ȩ����CH3CH2OH�У����γɷ��Ӽ�������� �� ���γɷ������������ �� �����γ����������(�����)
���ݶ��ǻ�����ȩ����CH3CH2OH�У����γɷ��Ӽ�������� �� ���γɷ������������ �� �����γ����������(�����)
��3���ھ����NaCl���ڸɱ����۽��ʯ���ܽ������У��乹����֮����������ֱ����������������۵���ߵ��� �� ��͵���(�����)��
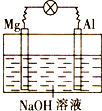
��4�����ڻ�ʱ��Ҫ�˷�H2O���Ӽ�������������CS2ʱ��������֮������á�
��5����NCl3��PCl3��AsCl3��SbCl3�зе���͵�������KF��KCl��KBr��KI�У��۵���ߵ�����
���𰸡�
��1���٢ܣ��ڢ�
��2���ڢݢޣ��ܣ��٢�
��3�����Ӽ������»��������ۼ������������ۣ���
��4�����»�������������»���
��5��NCl3��KF
��������(1)��������γɵ�������X��H��Y��X��Y����Ϊ�縺�Դ�ķǽ�������N��O��F����Y��Ӧ�йµ��Ӷԣ��ɴ˿����жϢڢۿ����γ������(2)��(1)�ⷨ���ơ�(3)����������Ϊ���Ӿ��塢���Ӿ��塢ԭ�Ӿ��塢�������壬Ȼ���ж�����������ǿ�������ݸ��������ʣ��۵���ߵ�һ��Ϊԭ�Ӿ��壻��͵�һ��Ϊ���Ӿ��塣(4)H2O�д���������ʱ��ڻ���˷����»����������S����CS2�������»�����(5)�ṹ��������Ƶķ����ڲ��������ʱ����Է�������Խ�е�Խ�ߣ���NCl3�е���͡����Ӿ����У�������(���Ľڻ�ѧ��)Խ�е�Խ�ߣ���뾶F��<Cl��<Br��<I�� �� ��K�����ʱ��K����F��֮�侧�������KF�۵���ߡ�