题目内容
 某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动:
某校甲、乙、丙三个化学兴趣小组利用课外活动时间,设计了不同的课题分别进行了实验探究活动:(1)甲小组进行中和滴定实验,实验室里只提供了下面几种仪器:酸式滴定管、碱式滴定管、量筒、托盘天平、普通漏斗、玻璃棒、烧杯,你认为还缺少的玻璃仪器是
锥形瓶
锥形瓶
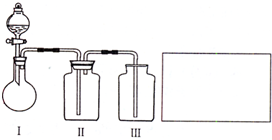
.(2)乙小组设计了如图所示的一套实验装置,以控究该装置的多功能性.
①李明同学认为该装置可以用来制取、收集SO2气体,其中III中盛有NaOH溶液.乙小组同学经过讲座后认为该装置存在安全隐患,需要将III进行改装,请将改装后的装置图画在方框内.
②王强同学认为可利用该装置快速制取、净化、收集氨气,其中II中盛有浓H2SO4.你认为是否正确,若正确则不需作答;若不正确,提出改进意见:
②Ⅱ应改为有碱石灰的干燥管或U形管,III应改为向下排空气法
②Ⅱ应改为有碱石灰的干燥管或U形管,III应改为向下排空气法
.(3)丙小组进入了一家回收含铜电缆废料的工厂做社会调查,技术员向同学们展示了两个处理方案,并向同学们提出了下列问题:
方案1:
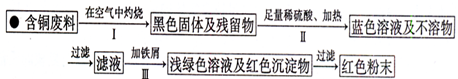
方案2:

①你认为方案
2
2
更符合当前绿色生产理念.②写出方案1中步骤Ⅱ反应的离子方程式
CuO+2H+=Cu2++H2O
CuO+2H+=Cu2++H2O
.③技术员指出,无论是方案1还是方案2,都应加入稍过量的铁屑并最终除去,请你设计除去铁屑的操作方法
将所得红色粉末用稀盐酸或稀硫酸浸泡后,再过滤、洗涤、干燥
将所得红色粉末用稀盐酸或稀硫酸浸泡后,再过滤、洗涤、干燥
.④为了增加经济效益,该工厂把最后一步所得浅绿色溶液,通过
蒸发浓缩
蒸发浓缩
、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品.⑤丙组同学经查询资料,研究、讨论,又设计了方案3,即把方案2中“加入足量稀硫酸、通入空气并加热”改为“加入足量稀硫酸和H2O2”,也可以得到同样的结果.该反应的化学方程式是
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
.分析:(1)根据中和滴定实验的仪器来回答;
(2)①二氧化硫有毒需要进行尾气处理;
②根据氨气的制取过程中含有的杂质是水蒸汽以及氨气的收集方法来回答;
(3)①绿色理念是指原料利用率高、操作简单、对环境无污染的理念;②氧化铜属于碱性氧化物,能和硫酸反应生成盐和水;③铁能溶于盐酸或硫酸而铜不溶.④将浅绿色溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品.⑤铜、双氧水和稀硫酸反应生成硫酸铜和水.
(2)①二氧化硫有毒需要进行尾气处理;
②根据氨气的制取过程中含有的杂质是水蒸汽以及氨气的收集方法来回答;
(3)①绿色理念是指原料利用率高、操作简单、对环境无污染的理念;②氧化铜属于碱性氧化物,能和硫酸反应生成盐和水;③铁能溶于盐酸或硫酸而铜不溶.④将浅绿色溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品.⑤铜、双氧水和稀硫酸反应生成硫酸铜和水.
解答:解:(1)中和滴定实验的玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶,故答案为:锥形瓶;
(2)①二氧化硫有毒需要进行尾气处理,可以将III进行改装为收集并防止倒吸和和尾气处理装置,即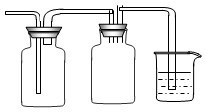 ,故答案为:
,故答案为: ;
;
②制的氨气中含有的水蒸气可以用碱石灰来干燥,不能使用浓H2SO4,因为氨气能和浓硫酸反应,氨气的密度小于空气,可以采用向上排空气法来收集,故答案为:Ⅱ应改为有碱石灰的干燥管或U形管,III应改为向下排空气法;
(3)①方案2中所有的铜原子均转化为硫酸铜,操作简单,符合当前的绿色理念,故答案为:2;
②氧化铜属于碱性氧化物,能和硫酸反应生成盐和水,方程式为CuO+2H+=Cu2++H2O;故答案为:CuO+2H+=Cu2++H2O;
③铁能溶于盐酸或硫酸而铜不溶,要除去红色粉末铜中所含过量的Fe得干燥的铜,可以将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥,故答案为:将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥.
④将浅绿色溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品.
故答案为:蒸发浓缩;
⑤铜、双氧水和稀硫酸反应生成硫酸铜和水反应的化学方程式Cu+H2O2+H2SO4=CuSO4+2H2O.
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O.
(2)①二氧化硫有毒需要进行尾气处理,可以将III进行改装为收集并防止倒吸和和尾气处理装置,即
 ,故答案为:
,故答案为: ;
;②制的氨气中含有的水蒸气可以用碱石灰来干燥,不能使用浓H2SO4,因为氨气能和浓硫酸反应,氨气的密度小于空气,可以采用向上排空气法来收集,故答案为:Ⅱ应改为有碱石灰的干燥管或U形管,III应改为向下排空气法;
(3)①方案2中所有的铜原子均转化为硫酸铜,操作简单,符合当前的绿色理念,故答案为:2;
②氧化铜属于碱性氧化物,能和硫酸反应生成盐和水,方程式为CuO+2H+=Cu2++H2O;故答案为:CuO+2H+=Cu2++H2O;
③铁能溶于盐酸或硫酸而铜不溶,要除去红色粉末铜中所含过量的Fe得干燥的铜,可以将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥,故答案为:将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥.
④将浅绿色溶液,通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥得到一种俗称“绿矾”的工业产品.
故答案为:蒸发浓缩;
⑤铜、双氧水和稀硫酸反应生成硫酸铜和水反应的化学方程式Cu+H2O2+H2SO4=CuSO4+2H2O.
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O.
点评:本题是一道化学实验方案设计和评价的题目,考查学生分析和解决问题的能力,注意平时知识的积累是解题的关键所在,难度较大.

练习册系列答案
相关题目
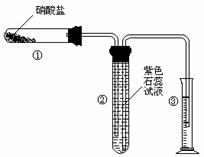
 程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科
程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科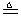 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,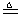 (Ⅰ)4AgNO3
2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3
2Ag2O+4NO2↑+O2↑,