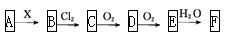题目内容
下列关于氯水的说法正确的是
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |
C
解析试题分析:A、向氯水中通入少量二氧化硫发生氧化还原反应生成盐酸和硫酸,氯水的漂白性减弱,A不正确;B、氯水中加入NaCl固体,溶液中氯离子浓度增大,则使平衡H2O+Cl2 H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
考点:考查氯水的组成、性质、浓度比较以及外界条件对平衡状态的影响

练习册系列答案
相关题目
某硫酸厂废气厂SO2的回收利用方案如下图所示,下列说法不正确的是: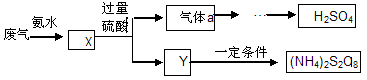
| A.X可能含有2种盐 | B.a是SO3 |
| C.Y可能含(NH4)2SO4 | D.(NH4)2S2O8中S元素的化合价不可能为+7 |
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如下图所示。下列有关三硫化四磷说法中正确的是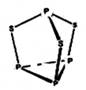
| A.该物质中磷元素的化合价为+3 |
B.该物质分子中含有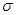 键和 键和 键 键 |
| C.该物质的熔、沸点比食盐高 |
| D.该物质22g含硫原子的数目约为1.806×1023 |
下列叙述中正确的是
| A.实验室制取氨气的发生装置与用高锰酸钾制取氧气的装置相同 |
| B.并不是所有的铵盐都能与烧碱共热生成氨气 |
| C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO |
| D.CO2、NO2、P2O5均与水反应生成酸为酸性氧化物 |
已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是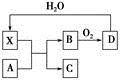
| A.X使蔗糖变黑的现象主要体现了X的脱水性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生 |
| D.工业上,B转化为D的反应条件为高温、高压、使用催化剂 |
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl—→2KCl+5Cl2↑+2MnCl2+8H2O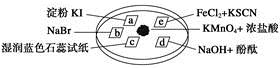
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
对下列事实的解释正确的是( )。
| A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 |
| B.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 |
| C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol |
| D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |
向5 mL 18 mol/L的硫酸中加入足量铜片并加热使其充分反应,下列说法正确的是( )
| A.有0.09 mol的硫酸被还原 |
| B.有0.045 mol的硫酸被还原 |
| C.充分反应后体系无硫酸剩余 |
| D.消耗的铜的质量一定小于2.88 g |