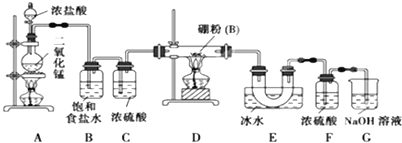
题目内容
【题目】【化学——选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:

(1)W+的电子排布式为 ,Y2X2分子中![]() 键与π键数之比为 。
键与π键数之比为 。
(2)化合物ZX3比YX4易液化,主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物分子的结构式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ;如果该晶体的密度为d g·cm--3,阿伏加德罗常数为NA,则晶体中两个距离最近的氯离子中心间的距离为 cm。
(5)ZX3的VSEPR构型为 ,ZF3分子的空间构型为 ;ZX3容易与W2+形成配离子,但ZF3不易与W2+形成配离子,其原因是 _。
【答案】(1)[Ar]3d10(1分)3:2(2分)
(2)NH3分子间存在氢键,沸点高,易液化(2分)
(3)![]() (2分)
(2分)
(4)CuCl(2分)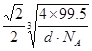 (2分)
(2分)
(5)四面体形(1分),三角锥形(1分);F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配位键(2分)
【解析】试题分析:原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,X是H;Y原子基态时最外层电子数是其内层电子数的2倍,Y是C;Z原子基态时2p原子轨道上有3个未成对的电子,Z是N;W的原子序数为29,W是Cu。
(1)铜的原子序数是29,则Cu+的电子排布式为[Ar]3d10,C2H2分子中含有2个碳氢单键和有关碳碳三键,则分子![]() 键与π键数之比为3:2。
键与π键数之比为3:2。
(2)NH3分子间存在氢键,沸点高,因此比甲烷易液化。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,这两种物质分别是CO2和N2O,根据CO2的结构式可知N2O的结构式是![]() 。
。
(4)根据晶胞的结构可知含有的原子个数分别是8×1/8+6×1/2=4、12×1/4+1=4,则化学式为CuCl;设晶胞的边长是acm,则晶体中两个距离最近的氯离子中心间的距离为![]() 。由于
。由于![]() ,所以晶体中两个距离最近的氯离子中心间的距离为
,所以晶体中两个距离最近的氯离子中心间的距离为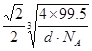 cm。
cm。
(5)NH3分子中氮元素的价层电子对数是4,所以其VSEPR构型为四面体形,NF3分子中氮元素的价层电子对数是4,但由于含有一对孤对电子,因此其分子的空间构型为三角锥形;由于F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配位键。

 名校课堂系列答案
名校课堂系列答案