题目内容
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为______.
(2)这样制取的二氧化硫气体中可能含有的杂质是______;原因是______.
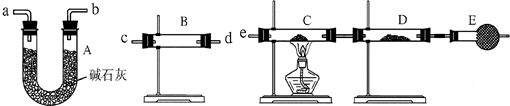
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是______(用a、b…填写).
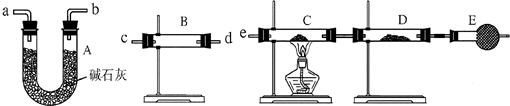
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ______ | ______ | ______ |
| C | CuO固体 | ______ | ______ |
解:(1)浓硫酸具有强氧化性,Zn与浓硫酸反应生成硫酸锌、二氧化硫、水,
反应方程式为:Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O.
故答案为:Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O.
(2)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g).
故答案为:氢气和水蒸气;随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,同时会有少量水蒸气.
(3)先检验水的存在,将水除尽,再检验H2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H2,所以气流方向为:c d(或d c)a b(或b a)e
故答案为:c d(或d c)a b(或b a)e.
(4)B装置检验水,装置内盛放无水硫酸铜,若固体由白色变成蓝色,说明SO2中含有水蒸气;
若含有H2,在装置C中发生反应H2+CuO Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气.
Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气.
故答案为:
分析:(1)浓硫酸具有强氧化性,Zn与浓硫酸反应生成硫酸锌、二氧化硫、水.
(2)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g).
(3)检验H2的方法常用灼热的CuO反应生成水,检验水的存在,这里有水蒸气的存在,注意操作的顺序,先检验水的存在,将水除尽,再检验H2和CuO反应生成的水.
(4)实验先检验是否含有水,利用无水硫酸铜吸水变蓝色检验;将水除尽,再检验H2和CuO反应生成的水.
点评:本题考查了浓硫酸的性质、常见气体检验的方法和操作顺序、对实验原理的理解等,难度中等,本题要检验SO2中是否含有H2和H2O(g),需要注意检验的顺序.方法类似于SO2中CO2的鉴别.先用品红检验SO2的存在,然后用酸性高锰酸钾溶液吸收,再用品红检验SO2是否吸收完全,然后通过澄清石灰水检验CO2.
反应方程式为:Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O.
故答案为:Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O.
(2)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g).
故答案为:氢气和水蒸气;随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,同时会有少量水蒸气.
(3)先检验水的存在,将水除尽,再检验H2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H2,所以气流方向为:c d(或d c)a b(或b a)e
故答案为:c d(或d c)a b(或b a)e.
(4)B装置检验水,装置内盛放无水硫酸铜,若固体由白色变成蓝色,说明SO2中含有水蒸气;
若含有H2,在装置C中发生反应H2+CuO
 Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气.
Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气.故答案为:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | 无水硫酸铜 | 固体由白色变成蓝色 | SO2中含有水蒸气 |
| C | C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色 | SO2中含有氢气 |
分析:(1)浓硫酸具有强氧化性,Zn与浓硫酸反应生成硫酸锌、二氧化硫、水.
(2)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g).
(3)检验H2的方法常用灼热的CuO反应生成水,检验水的存在,这里有水蒸气的存在,注意操作的顺序,先检验水的存在,将水除尽,再检验H2和CuO反应生成的水.
(4)实验先检验是否含有水,利用无水硫酸铜吸水变蓝色检验;将水除尽,再检验H2和CuO反应生成的水.
点评:本题考查了浓硫酸的性质、常见气体检验的方法和操作顺序、对实验原理的理解等,难度中等,本题要检验SO2中是否含有H2和H2O(g),需要注意检验的顺序.方法类似于SO2中CO2的鉴别.先用品红检验SO2的存在,然后用酸性高锰酸钾溶液吸收,再用品红检验SO2是否吸收完全,然后通过澄清石灰水检验CO2.

练习册系列答案
相关题目
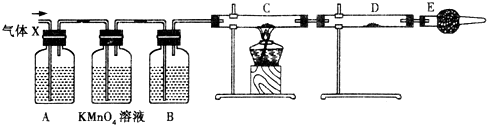
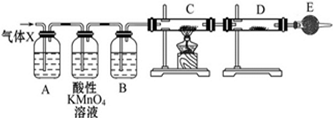 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答:
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,有同学认为产生的气体除SO2外,还可能产生氢气.该同学为了检验他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去).试回答: