题目内容
20.在铜的冶炼过程中有如下反应发生5FeS2+14CuSO4+12H2O═7Cu2S+5FeSO4+12H2SO4关于此反应,下列说法正确的是( )| A. | Cu2S既是氧化产物,又是还原产物 | |
| B. | 产物中的SO42-有一部分是氧化产物 | |
| C. | FeS2只作还原剂 | |
| D. | 5 mol FeS2发生反应,有10 mol电子转移 |
分析 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中,Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂,从元素化合价的角度判断并计算该题.
解答 解:A.反应中Cu元素的化合价降低,硫化亚铜中的硫是由硫化亚铁中-1价的硫降低到-2价,则Cu2S只是还原产产物,故A错误;
B.由化学方程式可知,反应物中含有14molSO42-离子,生成物中有17molSO42-离子,则有3molS被氧化,所以SO42-有一部分是氧化产物,故B正确;
C.FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂,故C错误;
D.5molFeS2发生反应,Cu元素化合价由+2价→+1价,14molCuSO4得到14mol电子,FeS2→Cu2S,S元素的化合价由-1价→-2价,生成7molCu2S,得到7mol电子,有21mol电子转移,故D错误;
故选B.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意把握元素化合价的判断,从化合价变化的角度分析,题目难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
15.化学与生活、社会密切相关.下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 华裔科学家高锟在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
5.己烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是( )

| A. | 可以用有机溶剂萃取 | |
| B. | 可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
12.下列说法正确的是( )
| A. | 常温下,反应2A (s)+B (g)═2C (g)+D (g)不能自发进行,则该反应△H一定大于0 | |
| B. | 101kPa时,2 H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| C. | C (石墨,s)═C (金刚石,s)△H1=+1.9kJ•mol-1,则由石墨制取金刚石的吸热反应,金刚石比石墨稳定 | |
| D. | 0.5molH2SO4与0.5mol Ba(OH)2完全反应所放出的热量即为中和热 |
9.下列有关化学用语表示正确的是( )
| A. | Al3+的结构示意图: | B. | 水的电子式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 含有7个中子的碳原子:${\;}_{6}^{7}$C |
10.同温同压下,等容积的两个密闭容器中分别充满一氧化碳${\;}_{\;}^{12}$C${\;}_{\;}^{18}$O、${\;}_{\;}^{14}{N}_{2}$各一种气体.关于这两个容器中的气体的下列说法中,正确的是( )
| A. | 所含质子总数、中子总数都相等 | B. | 气体的质量相等 | ||
| C. | 所含原子总数、质子总数都相等 | D. | 所含分子总数不相等 |


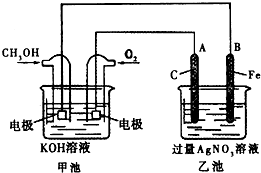 据报道,摩托罗拉公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{放电}^{充电}$K2CO3+6H2O
据报道,摩托罗拉公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH$?_{放电}^{充电}$K2CO3+6H2O