题目内容
20.某温度下,碳酸钠饱和溶液的质量分数为a%,向其中加入x molNa2CO3•5H2O或ymolNa2CO3,可析出相同质量的Na2CO3•10H2O,则下列叙述正确的是( )| A. | a%可能为39%,x一定大于y | |
| B. | a%可能为39%,x可能大于、等于、小于y | |
| C. | a%可能为30%,x一定大于y | |
| D. | a%可能为30%,x可能大于、等于、小于y |
分析 运用假设法,设向饱和碳酸钠溶液中加入x molNa2CO3•5H2O或ymolNa2CO3,因为Na2CO3•5H2O含有结晶水,所以吸收饱和溶液中的水应比Na2CO3少,析出晶体也较少,而要析出相同质量的Na2CO3•10H2O,必须满足x>y,依据计算析出Na2CO3•10H2O中碳酸钠的质量分数,运用极值法判断饱和碳酸钠溶液的质量分数,判断a%的大小,据此解答.
解答 解:溶液为饱和碳酸钠溶液,若x=y,则饱和溶液中加入xmolNa2CO3?5H2O的被吸收的水与加入xmolNa2CO3吸收的水相比较少则析出晶体也较少,要使溶液析出相同质量的Na2CO3?10H2O则必须满足:x>y,排除:BD;在Na2CO3?5102O中,Na2CO3的质量分数ω=$\frac{106g}{286g}$×100%=37.06%,饱和溶液的质量分数应小于37.06%,
故选:C.
点评 本题考查了饱和溶液,熟悉溶解度概念、饱和溶液的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
11.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 25℃、101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
8.下列变化中需加入还原剂才能实现的是( )
| A. | Cl-→Cl2 | B. | CuO→Cu | C. | Fe2+→Fe3+ | D. | H2SO4→BaSO4 |
15.下列各组物质的分类正确的是( )
| A. | 同位素:${\;}_{\;}^{1}$H2O、${\;}_{\;}^{2}$H2O、${\;}_{\;}^{3}$H2O | |
| B. | 同系物:CH4、C2H6、C8H18 | |
| C. | 同素异形体:H2、D2、T2 | |
| D. | 胶体:饱和氯化铁溶液、淀粉溶液、牛奶 |
5.只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液,这种试剂是( )
| A. | 饱和Na2CO3溶液 | B. | Cu(OH)2悬浊液 | C. | 烧碱溶液 | D. | 碘水 |
12.化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等.下列说法正确的是( )
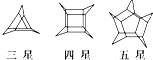

| A. | 它们之间互为同系物 | |
| B. | 六星烷的化学式为C18H23 | |
| C. | 三星烷与丙苯互为同分异构体,四星烷与 互为同分异构体 互为同分异构体 | |
| D. | 它们的一氯代物均只有3种 |
9.从如图的溶解度曲线图,可获得的信息是( )


| A. | A、B、C三种物质中A的溶解度最大 | |
| B. | 通过蒸发溶剂的方法可将C从不饱和溶液变成饱和溶液 | |
| C. | 20℃时,100g水中溶解30g A可达到饱和 | |
| D. | 80℃时,100g水不能将50g B溶解完全,而能完全溶解50g C |
5.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | 2Fe3++2I-═2Fe2++I2 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2+3 H2O | D. | 3 Cl2+6 FeI2═2FeCl3+4FeI3 |
 (1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: