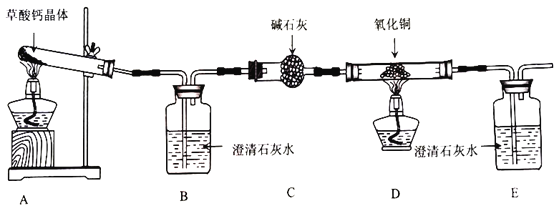
题目内容
【题目】CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是
CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是
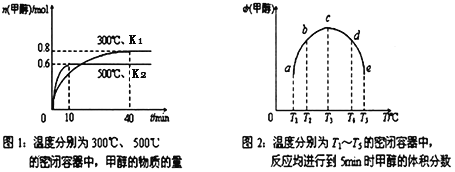
A. 该反应的ΔH<0
B. 在500℃条件下达平衡时CO 的转化率为60%
C. 平衡常数K1(3000C)<K2(5000C)
D. 图2中达化学平衡的点为c、d、e
【答案】C
【解析】
根据图1,随着温度升高,甲醇的物质的量减小,根据勒夏特列原理,该反应为放热反应,根据图2,当反应达到平衡时,甲醇的物质的量最大,依据化学平衡移动的定义,推出c、d、e达到平衡;
A、根据图1,300℃时,甲醇物质的量为0.8mol,500℃时甲醇物质的量为0.6mol,升高温度,向正反应方向移动,根据勒夏特列原理,该反应为放热反应,即△H<0,故A说法正确;
B、500℃时甲醇的物质的量为0.6mol,则消耗CO的物质的量为0.6mol,即CO的转化率为0.6mol/1mol×100%=60%,故B说法正确;
C、化学平衡常数只受温度的影响,该反应为放热反应,升高温度,平衡向逆反应方向进行,即化学平衡常数减小,即K1(300℃)>K2(500℃),故C说法错误;
D、a到c反应向正反应方向进行,还没有达到平衡,当达到平衡时,甲醇的物质的量最多,即c、d、e为化学平衡点,故D说法正确;

练习册系列答案
相关题目