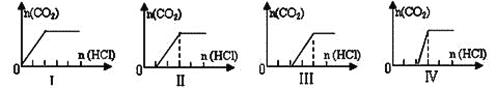
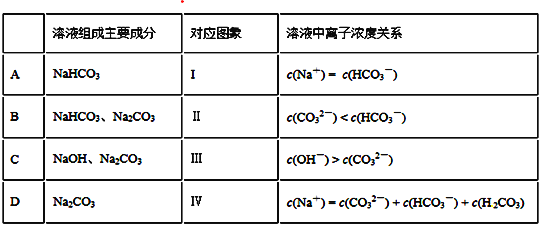
题目内容
【题目】将FeCl3、CuCl2混合溶液加入一定质量的铁粉中充分反应,所加混合溶液的体积与反应后剩余固体质量如图所示。已知原混合溶液中Fe3+浓度为0.200 mol/L,经检测M点时溶液中无Cu2+;

求:
(1)c(CuCl2 )=______mol·L-1。
(2)铁粉的质量_______g。
【答案】 0.700或0.70 44.8
【解析】(1)氧化性是铁离子大于铜离子,铁离子首先氧化金属铁。经检测M点时溶液中无Cu2+,固体质量不变,根据2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu可知消耗的铁的质量与析出的铜的质量相等。设氯化铜的物质的量是xmol,铁离子是0.2mol,则(0.1+x)×56=64x,解得x=0.7,因此c(CuCl2 )=0.7mol÷1L=0.70mol·L-1。(2)加入8L溶液时固体全部溶解,这说明铁只与铁离子反应,铁离子是1.6mol,则铁粉的质量是0.8mol×56g/mol=44.8g。

【题目】25℃时,物质的量浓度均为0.1molL-1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_____molL﹣1;Ka(CH3COOH)_____Kb(NH3H2O)(填“>”、“<”或“=”)。
(4)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1molL-1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(5)某同学欲用0.1molL-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。