题目内容
17.等质量的下列有机物充分燃烧时,消耗氧气最多的是( )| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 乙醇 |
分析 由C~O2~CO2,4H~O2~2H2O可知,消耗1molO2需要12gC,而消耗1molO2需要4gH,可知等质量时,烃中氢元素质量分数越大,消耗的O2越多,乙醇可以改写为C2H4.H2O,质量相等时,耗氧量小于乙烯,以此进行比较.
解答 解:由C~O2~CO2,4H~O2~2H2O可知,消耗1molO2需要12gC,而消耗1molO2需要4gH,可知等质量时,烃中氢元素质量分数越大,消耗的O2越多,
CH4、C2H4、C6H6分子中C、H原子数目之比分别为1:4、1:2、1:1,故CH4、C2H4、C6H6中CH4的含氢量最大,等质量时,计算消耗的氧气应最多,乙醇可以改写为C2H4.H2O,质量相等时,耗氧量小于乙烯,故相同质量时甲烷消耗氧气最多,
故选A.
点评 本题考查有机物耗氧量的判断,难度不大,注意比较C、H原子消耗氧气的关系得出:等质量时烃中氢元素质量分数越大,消耗的O2越多,注意将乙醇改写为C2H4.H2O与乙烯比较,避免计算的繁琐.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
7.在2A+B?3C+4D中,下列表示该反应的速率最快的是( )
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.8mol•L-1•s-1 | D. | v( D )=1.0mol•L-1•s-1 |
8.在使用燃气热水器过程中,因通风不良造成煤气得不到完全燃烧,一氧化碳浓度严重超标,人过量吸入就会引起中毒.下列物质中,与一氧化碳属于同类物质的是( )
| A. | H2、O3 | B. | H2SO4、H2CO3 | C. | SO2、NO | D. | Na2SO3、KClO3 |
6.已知可逆反应:2X(g)+Y(g)?mZ(g)△H=-a kJ•mol-1(a>0).
现有甲、乙两个容积相等的容器,向甲容器中充入2mol X和1mol Y,达到平衡时放出热量b kJ;
向乙容器中充入1mol X和0.5mol Y,达到平衡时放出热量c kJ,且b>2c,则a、b的大小关系及m的值域正确的是( )
现有甲、乙两个容积相等的容器,向甲容器中充入2mol X和1mol Y,达到平衡时放出热量b kJ;
向乙容器中充入1mol X和0.5mol Y,达到平衡时放出热量c kJ,且b>2c,则a、b的大小关系及m的值域正确的是( )
| A. | a=b m=3 | B. | a>b m<3 | C. | a>b m≤2 | D. | a<b m≤2 |
7.现有FeS和Fe(OH)3的混合物28.3克,与足量稀硫酸反应,生成沉淀1.6克混合物中含有Fe(OH)3的质量可能为( )
| A. | 10.7g | B. | 21.4g | C. | 23.9g | D. | 40g |

 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 .
.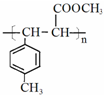 .
.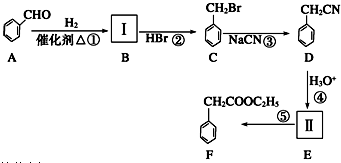
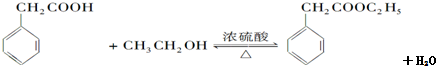 (要求写出反应条件).
(要求写出反应条件). (要求写出反应条件).
(要求写出反应条件). .
.