题目内容
(I)在一定条件下,发生反应: aA(g)+bB(g) cC(g)△H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:
cC(g)△H=Q kJ/mol,其化学平衡常数K和温度的关系如下表所示:

依据图表判断该反应△H?????? 0(填“>”或“<”):若其它条件保持一定,降低温度,该反应物A的转化率???????? (填“增大”、“减小”或“不变”下同),化学反应速率将???????? 。

 (II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?? cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
(II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?? cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
(1)该化学方程式中a:b:c为?????????? ,t℃时该反应的化学平衡常数K的值为____?????? 。(保留2位小数)
(2)0~15 min内,B的平均反应速率为???????????????? ,反应达平衡时,A的转化率为????????????????? 。
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是????????????? (用文字表达),反应重新达平衡时,A的体积分数将??????????????? (填“增大”、“减小”或“不变”)。
(4)10 min到15 min的曲线变化的原因可能是????????????????????????????????? 。
(I)<? 增大? 减小
(II)(1)2:1:2?? 0.31? (每空2分)
(2)0.0033 mol/( L·min) 20%? (每空2分)
(3)增大了B的量(合理答案给分)减小
(4)使用了催化剂? (除标明外其余每空1分)
【解析】
试题分析:(I)温度升高,化学平衡常数减小,说明升温平衡逆向移动,正向是放热反应,△H<0,降低温度平衡正向移动,反应物A的转化率增大,反应速率减小;
(II)(1)10 min时,A、B、C的物质的量的改变量分别是0.1mol、0.05mol、0.1mol,所以该化学方程式中a:b:c为2:1:2;15 min达平衡时,A、B、C的物质的量浓度分别为0.4mol/L、0.2 mol/L、0.1 mol/L,所以K=0.12/(0.42×0.2)=0.31
(2)0~15 min内,B的浓度变化是0.05mol/L,所以B的平均反应速率为0.05mol/L/15 min=0.0033 mol/( L·min),平衡时A的物质的量变化是0.2mol,所以A的转化率为0.2mol/1.0mol=20%;
(3)反应进行至20 min时,B的物质的量陡然增加,所以曲线发生变化的原因是B的物质的量增加了,平衡正向移动,所以A的体积分数将减小;
(4)10 min时反应未达平衡, A、B、C的反应速率瞬间增大,且反应仍正向进行,所以可能是加入了催化剂
考点:考查化学平衡中与反应热、化学反应速率、转化率、图像分析有关的知识

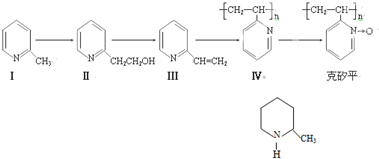
克砂平是治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
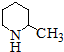
(1)化合物I的分子式为___________,其某些化学性质类似于苯。例如,化合物I可在
一定条件下与氢气发生加成反应生成 ,其反应方程式(不要求标出反应条件)
,其反应方程式(不要求标出反应条件)
为: _______________________________________。
(2)化合物I生成化合物II是原子利用率为100%的反应,所需另一反应物的分子式为: 。
(3)下列关于化合物II和化合物III的化学性质,说法正确的是 (填字母)
| A.化合物II可以与CH3COOH发生酯化反应 |
| B.化合物II不可以与金属Na反应生成氢气 |
| C.化合物II不可以使酸性高锰酸钾溶液褪色 |
| D.化合物III可以使溴的四氯化碳溶液褪色 |
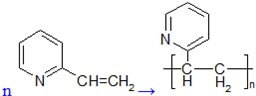
(4)化合物III生成化合物Ⅳ的反应方程式为(不要求标出反应条件):
。

 ,其反应方程式为
,其反应方程式为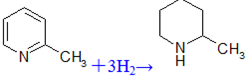
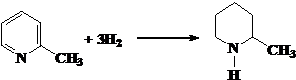


 ,其反应方程式(不要求标出反应条件)
,其反应方程式(不要求标出反应条件)