题目内容
1.下列元素属于第IIA族的是( )| A. | 硼 | B. | 锂 | C. | 氢 | D. | 镁 |
分析 选项中均为主族元素,主族元素周期数=电子层数、最外层电子数=族序数.
解答 解:A.硼原子核外有2个电子层、最外层电子数为3,处于第二周期ⅢA族,故A不选;
B.Li原子核外有2个电子层、最外层电子数为1,处于第二周期IA族,故B不选;
C.H原子核外有1个电子层、电子数为1,处于第一周期IA族,故C不选;
D.Mg原子核外有3个电子层、最外层电子数为2,处于第二周期ⅡA族,故D选,
故选D.
点评 本题考查结构与位置的关系,难度不大,旨在考查学生的基础知识掌握情况,关键在于明确主族元素周期数=电子层数,最外层电子数=族序数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的化学反应速率为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
9.下列事件处理中,不正确的是( )
| A. | 用福尔马林保存生物标本 | |
| B. | 试管上沾有苯酚时,用水洗 | |
| C. | 实验室不慎将Hg洒在地上时,立即用硫粉覆盖 | |
| D. | 皮肤上沾有苯酚时,立即用酒精擦洗 |
6.下列物质不能通过化合反应直接制得的是( )
| A. | FeCl2 | B. | H2SiO3 | C. | NH4NO3 | D. | HCl |
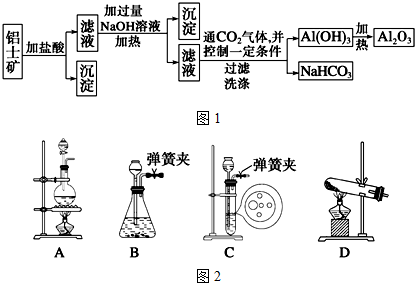
13.以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
(1)滤液P中含有的阳离子有H+、Fe2+、Mg2+.
(2)过程Ⅱ中发生的氧化还原反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知:
过程Ⅲ中加入NH3•H2O调节溶液pH约为4,其目的是使Fe3+沉淀完全而Mg2+不沉淀.
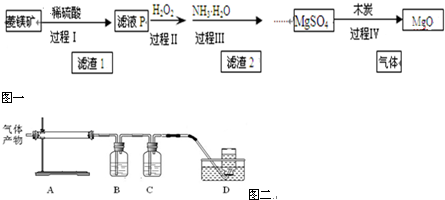
(4)过程Ⅳ在800℃煅烧MgSO4,发生多个反应,产物除MgO外,还有SO2、CO2、CO、S等气体产物,利用右图装置判断煅烧产生的气体.
①A中试管壁附着有淡黄色固体,该固体的化学式是S.
②B中盛放的溶液是(填字母)d.
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4溶液
③写出800℃煅烧MgSO4,产生气体产物是S 和CO的化学方程式MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.

(1)滤液P中含有的阳离子有H+、Fe2+、Mg2+.
(2)过程Ⅱ中发生的氧化还原反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知:
| Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| 开始沉淀的pH | 10.4 | 1.9 | 7.0 |
| 沉淀完全的pH | 12.4 | 3.2 | 9.0 |
(4)过程Ⅳ在800℃煅烧MgSO4,发生多个反应,产物除MgO外,还有SO2、CO2、CO、S等气体产物,利用右图装置判断煅烧产生的气体.
①A中试管壁附着有淡黄色固体,该固体的化学式是S.
②B中盛放的溶液是(填字母)d.
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4溶液
③写出800℃煅烧MgSO4,产生气体产物是S 和CO的化学方程式MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.
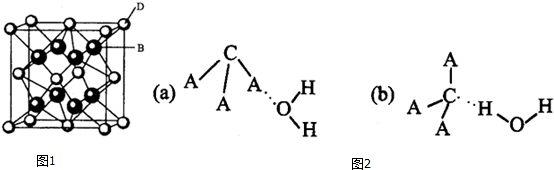
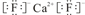 ;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).
;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式). 酚
酚 酮
酮 酯
酯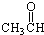 醛
醛 酸.
酸.