题目内容
【题目】元素周期表的形式多种多样,如下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是( ) 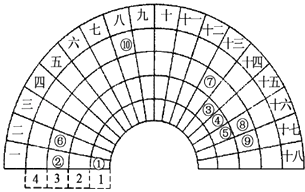
A.②、⑧、⑨对应简单离子半径依次减小
B.⑤的三种核素化学性质不同
C.元素=10 ⑩处于常见周期表第四周期第VIIIB族
D.④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
【答案】D
【解析】解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2﹣>Cl﹣>Na+ , 故A错误;
B.同素异形体,化学性质相同,物理性质不同,则氧的三种核素化学性质不同,故B错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,故C错误;
D.的最高价氧化物对应的水化物是硝酸,与氢化物氨气反应可以形成离子化合物NH4NO3 , 分子中都含有极性键、离子键,是离子化合物,故D正确.
故选D.

练习册系列答案
相关题目