题目内容
甲、乙两容器都发生反应2 A(g)+B(g) 3C(g),两容器温度和初始压强都相同。在甲恒容容器中充入2 mol A和1 mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4 mol A、0.7 mol B和0.6 mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2。下列说法中正确的是( )
3C(g),两容器温度和初始压强都相同。在甲恒容容器中充入2 mol A和1 mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4 mol A、0.7 mol B和0.6 mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2。下列说法中正确的是( )
A.φ1>φ2 B.n1>n2 C.n1=n2 D.φ1<φ2
 3C(g),两容器温度和初始压强都相同。在甲恒容容器中充入2 mol A和1 mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4 mol A、0.7 mol B和0.6 mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2。下列说法中正确的是( )
3C(g),两容器温度和初始压强都相同。在甲恒容容器中充入2 mol A和1 mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4 mol A、0.7 mol B和0.6 mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2。下列说法中正确的是( )A.φ1>φ2 B.n1>n2 C.n1=n2 D.φ1<φ2
B
因为若X=3则恒压或恒容条件都一样,只要符合比例就等效,达平衡后C在平衡混合气中的体积分数相等,则A、D错误;由于两容器的“初始压强”相同,即初始体积不一样,开始时两容器体积比为物质的量之比3:2.7=10∶9,即此时乙比甲投料总物质的量少(乙容器相当于充入1.8 mol A和0.9 mol B),所以达平衡时n1>n2,则C错误,B正确。

练习册系列答案
相关题目
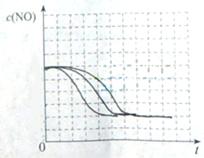
 2C(g)△H<0,下列图象正确的是( )
2C(g)△H<0,下列图象正确的是( )
 C(g)+D(g)已达化学平衡状态的是( )
C(g)+D(g)已达化学平衡状态的是( )  2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。?
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。?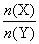 的取值范围为_______。
的取值范围为_______。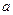 mol A和
mol A和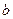 mol B在一个容积可变的容器中发生反应:A(g)+2B(g)
mol B在一个容积可变的容器中发生反应:A(g)+2B(g) 2C(g),一段时间后达到平衡,生成
2C(g),一段时间后达到平衡,生成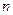 mol C。则下列说法中正确的是 ( )
mol C。则下列说法中正确的是 ( )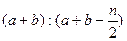
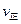 (A)=2
(A)=2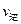 (B)时,可确定反应达平衡
(B)时,可确定反应达平衡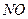 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的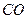 转变成
转变成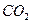 和
和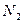 ,化学方程式如下:
,化学方程式如下:

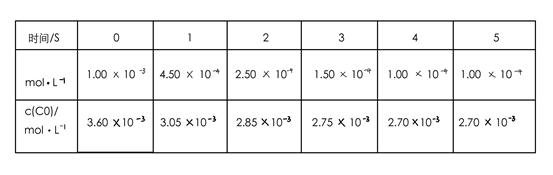
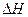 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。