题目内容
【题目】(1)用KClO3在H2SO4存在下与SO2反应制得ClO2。请写出反应的离子方程式:______。
(2)把ag固体NaHCO3加热分解一段时间后,固体质量变为b g。
①尚未分解的NaHCO3质量为________g。
②当b为________g时,表明NaHCO3完全分解。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
①上述反应中氧化剂是__________________。
②根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、
③淀粉、④白酒、⑤食醋,你认为必须选用的物质有___________(填序号)。
③某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
④请配平以下化学方程式:________□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+2H2O。若反应过程中转移5 mole-,则生成标准状况下N2的体积为________L。
【答案】2ClO3-+SO2=2ClO2+SO42- ![]()
![]() NaNO2①②⑤B10 6 4 10 311.2
NaNO2①②⑤B10 6 4 10 311.2
【解析】
(1)KClO3在H2SO4存在下与SO2反应制得二氧化氯,同时生成硫酸钾;(2)反应前固体为NaHCO3,反应后为未反应的NaHCO3和反应生成的Na2CO3的混合物,找到反应物Na2CO3和反应前后固体质量差对应的正比例关系即可迅速解题;(3)氧化还原反应中,化合价降低元素所在的反应物是氧化剂;根据反应时有沉淀、气体、颜色变化等明显现象选择试剂;选择试剂时要考虑既能使NaNO2转化又无二次污染;反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30。
(1)KClO3在H2SO4存在下与SO2反应制得二氧化氯,同时生成硫酸钾,则离子反应为2ClO3-+SO2=2ClO2+SO42-。(2)设分解的碳酸氢钠质量为x,则:
2NaHCO3![]() Na2CO3+CO2↑+H2O △m=—62g
Na2CO3+CO2↑+H2O △m=—62g
168 62
x (a—b)
由化学方程式可知x=![]() ,则尚未分解的NaHCO3质量为a-
,则尚未分解的NaHCO3质量为a-![]() =
=![]() ;NaHCO3完全分解时,生成的碳酸钠的质量为bg,则bg=
;NaHCO3完全分解时,生成的碳酸钠的质量为bg,则bg=![]() g,故b为
g,故b为![]() 。(3)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,所以NaNO2是氧化剂;①水、③淀粉、④白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,故选①②⑤;NaNO2→N2是被还原,必须加还原剂,N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂,反应的方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,故选B;反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH-系数为4,由H元素守恒可知H2O前面的系数为2,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,转移30mol电子会有3mol氮气生成,根据电子转移守恒,有5mol电子转移时生成氮气的物质的体积为11.2L。
。(3)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,所以NaNO2是氧化剂;①水、③淀粉、④白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,故选①②⑤;NaNO2→N2是被还原,必须加还原剂,N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂,反应的方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,故选B;反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH-系数为4,由H元素守恒可知H2O前面的系数为2,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,转移30mol电子会有3mol氮气生成,根据电子转移守恒,有5mol电子转移时生成氮气的物质的体积为11.2L。

【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
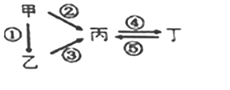
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D
