题目内容
将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
| A.溶液的pH增大 | B.CH3COOH电离的百分率变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
A
试题分析:在CH3COOH溶液中存在电离平衡:CH3COOH
 CH3COO-+H+。当加水稀释时,c(CH3COOH )、c(CH3COO-)、c(H+)都减小,电离平衡正向移动,使离子浓度又有所增大,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,所以溶液的pH增大;CH3COOH电离的百分率变大;溶液的导电能力减弱;因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。当加入少量CH3COONa晶体时,盐电离产生的CH3COO-使c(CH3COO-)增大,电离平衡CH3COOH
CH3COO-+H+。当加水稀释时,c(CH3COOH )、c(CH3COO-)、c(H+)都减小,电离平衡正向移动,使离子浓度又有所增大,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,所以溶液的pH增大;CH3COOH电离的百分率变大;溶液的导电能力减弱;因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。当加入少量CH3COONa晶体时,盐电离产生的CH3COO-使c(CH3COO-)增大,电离平衡CH3COOH CH3COO-+H+。向逆向移动,c(CH3COOH )、c(H+)都减小。c(H+)越小,溶液的pH增大。由于加入CH3COONa晶体抑制酸的电离,所以溶液中CH3COOH电离的百分率变小。因为溶液中的自由移动的离子浓度增大,所以溶液的导电性增强。因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。故将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起溶液的pH增大。选项为A。
CH3COO-+H+。向逆向移动,c(CH3COOH )、c(H+)都减小。c(H+)越小,溶液的pH增大。由于加入CH3COONa晶体抑制酸的电离,所以溶液中CH3COOH电离的百分率变小。因为溶液中的自由移动的离子浓度增大,所以溶液的导电性增强。因为在溶液中c(H+) ·c(OH-)=Kw不变。c(H+)减小,所以c(OH-)增大。故将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起溶液的pH增大。选项为A。
练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体 减小
减小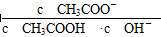 不变
不变 NH3·H2O+H+
NH3·H2O+H+