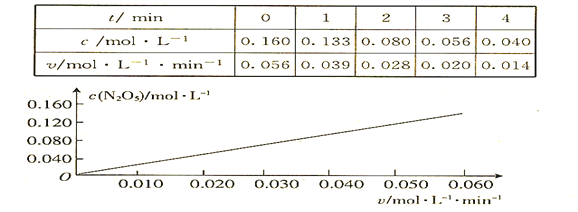
题目内容
【题目】在2L恒容恒温密闭容器中,起始时按下表的量投入(容器中固体体积可忽略不计)物质,发生CaS(s)+ CO2(g)![]() CaCO3(s)+ H2S(g),该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977。
CaCO3(s)+ H2S(g),该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977。
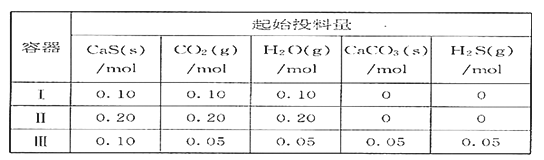
下列说法正确的是
A. 正反应为吸热反应
B. CO2 的平衡转化率:容器II = 容器III
C. H2S的平衡浓度:容器I = 容器III
D. 若容器I达平衡时,CO2的转化率为90%,则该温度下反应的平衡常数K=900
【答案】C
【解析】试题分析:因为该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977,当温度升高后,K减小,所以该反应为放热反应。在2L恒容恒温密闭容器中,起始时按表中的量投入(容器中固体体积可忽略不计)物质,发生CaS(s)+ CO2(g)![]() CaCO3(s)+ H2S(g),由于该反应是一个气体分子数不变的反应,虽然水蒸气的投料不同,但是水蒸气不影响化学平衡,所以表中的3次不同的投料所达到平衡状态是等效的。A. 因为该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977,当温度升高后,K减小,所以该反应为放热反应,A不正确;B. 容器II 和 容器III达到等效平衡,但容器III的起始投料有生成物,所以两容器中CO2 的平衡转化率不相同,B不正确;C. 容器I 和 容器III中投料除水蒸气不同外,其他投料是相当的,容器I 和 容器III达到等效平衡,容器I 和容器III 中H2S的平衡浓度相同,C正确;D. 若容器I达平衡时,CO2的转化率为90%,则CO2的变化量为0.10mol
CaCO3(s)+ H2S(g),由于该反应是一个气体分子数不变的反应,虽然水蒸气的投料不同,但是水蒸气不影响化学平衡,所以表中的3次不同的投料所达到平衡状态是等效的。A. 因为该反应的平衡常数与温度的关系为lgK = (5003/T )—6.977,当温度升高后,K减小,所以该反应为放热反应,A不正确;B. 容器II 和 容器III达到等效平衡,但容器III的起始投料有生成物,所以两容器中CO2 的平衡转化率不相同,B不正确;C. 容器I 和 容器III中投料除水蒸气不同外,其他投料是相当的,容器I 和 容器III达到等效平衡,容器I 和容器III 中H2S的平衡浓度相同,C正确;D. 若容器I达平衡时,CO2的转化率为90%,则CO2的变化量为0.10mol![]() ,CO2的平衡量是0.01mol,CO2的平衡浓度为0.005mol/L,H2S的平衡量为0.09mol,H2S的平衡浓度为0.045mol/L,则该温度下反应的平衡常数K=
,CO2的平衡量是0.01mol,CO2的平衡浓度为0.005mol/L,H2S的平衡量为0.09mol,H2S的平衡浓度为0.045mol/L,则该温度下反应的平衡常数K=![]() ,D不正确。本题选C。
,D不正确。本题选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案