��Ŀ����
����Ŀ��������������(C12H22O11)�����ձ��У����뼸��ˮ��������ȣ�Ȼ���ټ���������Ũ���ᣬѸ�ٽ��裬�ų��������ȣ�ͬʱ�۲쵽������ڡ�Ƭ�̺�ɫ���ʼ������ͣ������������̼�����ζ������(ʵ�������ͼ��ʾ)
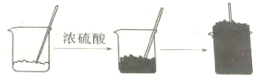
(1)������������Ũ�����__________�ԡ�
(2)Ϊ��ȷ���̼�����ζ����ijɷ֣��ռ����������壬�ֱ��������ʵ�顣
�ٽ�����ͨ��Ʒ����Һ����Һ��ɫ�����ȣ���ɫ�ָ���˵����������һ������_________��
�ڽ�����ͨ�����ʯ��ˮ����Һ����ǣ�_________(������������������)֤�������к���CO2��������Ϊ______(�����ӷ���ʽ��ʾ)��
�۴̼�����ζ���������ԭ����û�ѧ����ʽ��ʾΪ___________________________��
���𰸡���ˮ SO2 ���� Ca2++2OH-+SO2= CaSO3��+H2O 2H2SO4(Ũ)+C ![]() CO2��+2H2O+2SO2��
CO2��+2H2O+2SO2��
��������
Ũ���������ˮ�Ժ�ǿ�����ԣ����Խ�������H��O��2:1�ı�����ȥ��ʣ��C�������ڣ�ͬʱŨ���ỹ����̼��Ӧ����̼����ΪCO2����������ԭΪSO2�������������壬ʹʣ�µĹ���̼���ͣ��������
(1)���ݷ�����������������Ũ�������ˮ�ԡ�
(2)��SO2����Ư���ԣ�����ʹƷ����Һ��ɫ������ɫ���ʲ��ȶ������Ⱥ���ɫ��ָ�����������к���SO2��
�ڻ�������п��ܺ��ж��ֳɷ֣�����CO2���SO2��SO2Ҳ������ʯ��ˮ��Ӧ��SO2+Ca(OH)2=CaSO3��+H2O�����ɵ�CaSO3Ҳ�dz�������˲���֤��������һ������CO2����Ӧ�����ӷ���ʽΪ:Ca2++2OH-+SO2= CaSO3��+H2O��
�۴̼�����ζ��̼��Ũ���ᷴӦ������SO2����Ӧ����ʽΪ��2H2SO4(Ũ)+C ![]() CO2��+2H2O+2SO2��
CO2��+2H2O+2SO2��

����Ŀ��һ���¶��£����ݻ�Ϊ2L���ܱ������з�����ӦCO(g)+H2O(g) ![]() CO2(g)+H2(g)���������ݼ��±�������t2>t1��
CO2(g)+H2(g)���������ݼ��±�������t2>t1��
��Ӧʱ�䣯min | n(CO)��mol | n(H2O)��mol | n(CO2)��mol | n(H2)��mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
����˵����ȷ����
A. ��Ӧ��t1minĩ������Ϊv(H2)=0.40��t1 mol��L-1��min-1
B. ƽ��ʱCO��ת����Ϊ66��67��
C. ���¶��·�Ӧ��ƽ�ⳣ��Ϊ1
D. �����������䣬����ʼʱ��n(CO)=0.60 mol��n(H2O)=1.20 mol����ƽ��ʱn(CO2)=0.20mol




