题目内容
①~⑧是元素周期表中的部分元素.
请回答:
(1)元素③④⑧的气态氢化物中最稳定的是______(填化学式).
(2)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是______.
(3)元素⑥和⑧形成的化合物的电子式是______.
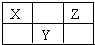
(4)某同学为了比较元素②和硅元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:
a.X是______(填化学式),B装置的作用是______.
b.能说明元素②和硅元素非金属性强弱的实验现象是______,相关的化学方程式是______.同主族元素从上到下______,得电子能力逐渐减弱,非金属性逐渐减弱.
(5)请设计实验比较元素⑥与⑦金属性的相对强弱______.

| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素③④⑧的气态氢化物中最稳定的是______(填化学式).
(2)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是______.
(3)元素⑥和⑧形成的化合物的电子式是______.
(4)某同学为了比较元素②和硅元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:
a.X是______(填化学式),B装置的作用是______.
b.能说明元素②和硅元素非金属性强弱的实验现象是______,相关的化学方程式是______.同主族元素从上到下______,得电子能力逐渐减弱,非金属性逐渐减弱.
(5)请设计实验比较元素⑥与⑦金属性的相对强弱______.

由元素在周期表在的位置可知,①为H,②为C,③为O,④为F,⑤为Na,⑥为Mg⑦为Al,⑧为Cl.
(1)③为O,④为F,⑧为Cl,F的非金属性最强,则HF最稳定,故答案为:HF;
(2)⑤和⑦的最高价氧化物对应水化物分别为NaOH、Al(0H)3,反应的离子反应为OH-+Al(0H)3═AlO2-+H2O,故答案为:OH-+Al(0H)3═AlO2-+H2O;
(3)⑥和⑧形成的化合物为氯化镁,属于离子化合物,其电子式为 ,故答案为:
,故答案为: ;
;
(4)a.X为除去二氧化碳中的HCl,则试剂为NaHCO3,B装置的作用为吸收CO2中混有的HCl气体,故答案为:NaHCO3;吸收CO2中混有的HCl气体;
b.因非金属性越强,最高价氧化物的水化物的酸性越强,则实验观察到C中产生白色胶状沉淀,发生的反应为CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,则同主族从上到下,电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,
故答案为:C中产生白色胶状沉淀;CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓;电子层数逐渐增加,原子半径逐渐增大;
(5)⑥为Mg⑦为Al,证明金属性的强弱,则取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象,反应剧烈的金属性强,故答案为:取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
(1)③为O,④为F,⑧为Cl,F的非金属性最强,则HF最稳定,故答案为:HF;
(2)⑤和⑦的最高价氧化物对应水化物分别为NaOH、Al(0H)3,反应的离子反应为OH-+Al(0H)3═AlO2-+H2O,故答案为:OH-+Al(0H)3═AlO2-+H2O;
(3)⑥和⑧形成的化合物为氯化镁,属于离子化合物,其电子式为
 ,故答案为:
,故答案为: ;
;(4)a.X为除去二氧化碳中的HCl,则试剂为NaHCO3,B装置的作用为吸收CO2中混有的HCl气体,故答案为:NaHCO3;吸收CO2中混有的HCl气体;
b.因非金属性越强,最高价氧化物的水化物的酸性越强,则实验观察到C中产生白色胶状沉淀,发生的反应为CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,则同主族从上到下,电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,
故答案为:C中产生白色胶状沉淀;CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓;电子层数逐渐增加,原子半径逐渐增大;
(5)⑥为Mg⑦为Al,证明金属性的强弱,则取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象,反应剧烈的金属性强,故答案为:取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目