题目内容
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+ , CeO2在该反应中作剂.
(2)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式: Cr2O72﹣+SO32﹣+□=Cr3++SO42﹣+H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 .
(4)NiSO4xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下: 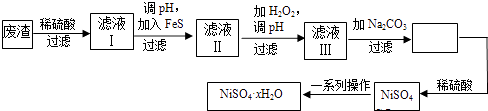
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为 .
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 .
③滤液Ⅲ溶质的主要成分是NiSO4 , 加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4 , 这两步操作的目的是 .
【答案】
(1)氧化剂
(2)1;3;8H+;2;3;4
(3)4Na+TiCl4 ![]() Ti+4NaCl
Ti+4NaCl
(4)FeS+Cu2+=CuS+Fe2+;除去Fe3+;增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4)
【解析】解:I、(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+ , Ce元素的化合价由+4价降低为+3价,则CeO2在反应中作氧化剂,所以答案是:氧化剂;(2)反应中Cr元素化合价由+6价降低到+3价,S元素化合价由+4价升高到+6价,则最小公倍数为12,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为:Cr2O72﹣+3SO32﹣+8H+═2Cr3++3SO42﹣+4H20,所以答案是:1;3;8H+;2;3;4;(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4 ![]() Ti+4NaCl;所以答案是:4Na+TiCl4
Ti+4NaCl;所以答案是:4Na+TiCl4 ![]() Ti+4NaCl;(4)①FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+; 所以答案是:FeS+Cu2+=CuS+Fe2+;②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+ , 然后调pH使Fe3+转化为氢氧化铁沉淀,从而除去Fe3+;所以答案是:除去Fe3+;③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4 , 这样可提高NiSO4的浓度,有利于蒸发结晶;所以答案是:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4).
Ti+4NaCl;(4)①FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+; 所以答案是:FeS+Cu2+=CuS+Fe2+;②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+ , 然后调pH使Fe3+转化为氢氧化铁沉淀,从而除去Fe3+;所以答案是:除去Fe3+;③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4 , 这样可提高NiSO4的浓度,有利于蒸发结晶;所以答案是:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4).

 科学实验活动册系列答案
科学实验活动册系列答案