��Ŀ����
��12�֣���2012?ɽ����[��ѧ�����ʽṹ������]�������ڵ�ء��Ͻ𡢴����ȷ���Ӧ�ù㷺��
��1�����й��ڽ�������������˵����ȷ������ ����
a�����������з������뱥����
b���������ǽ��������������ɵ��Ӽ�������
c��������������Ϊ����ӵ糡�����²������ɵ���
d���������й�������Ϊ�������������ղ��ų��ɼ���
��2��Ni��Ԫ�����ڱ��е�28��Ԫ�أ��ڶ����ڻ�̬ԭ��δ�ɶԵ�������Ni��ͬ�ҵ縺����С��Ԫ������ ����
��3�����˽��������Ni��CO��n������ԭ�Ӽ۵������������ṩ��������֮��Ϊ18����n=�� ��CO��N2�ṹ���ƣ�CO�����ڦҼ���м�����֮��Ϊ�� ����
��4����ȩ��H2C�TO����Ni�������¼���ɵü״���CH3OH�����״�������Cԭ�ӵ��ӻ���ʽΪ�� �����״������ڵ�O��C��H������ ��������ڡ������ڡ���С�ڡ�����ȩ�����ڵ�O��C��H���ǣ�
��1�����й��ڽ�������������˵����ȷ������ ����
a�����������з������뱥����
b���������ǽ��������������ɵ��Ӽ�������
c��������������Ϊ����ӵ糡�����²������ɵ���
d���������й�������Ϊ�������������ղ��ų��ɼ���
��2��Ni��Ԫ�����ڱ��е�28��Ԫ�أ��ڶ����ڻ�̬ԭ��δ�ɶԵ�������Ni��ͬ�ҵ縺����С��Ԫ������ ����
��3�����˽��������Ni��CO��n������ԭ�Ӽ۵������������ṩ��������֮��Ϊ18����n=�� ��CO��N2�ṹ���ƣ�CO�����ڦҼ���м�����֮��Ϊ�� ����
��4����ȩ��H2C�TO����Ni�������¼���ɵü״���CH3OH�����״�������Cԭ�ӵ��ӻ���ʽΪ�� �����״������ڵ�O��C��H������ ��������ڡ������ڡ���С�ڡ�����ȩ�����ڵ�O��C��H���ǣ�
��1��b��2��c��3��4��1��2��4��sp3����
��1��������û�з����Ժͱ����ԣ��������ǽ��������Ӻ����ɵ��Ӽ������ã�������������Ϊ���ɵ�������ӵ糡�����·��������ƶ��������й�������Ϊ���ɵ����ܹ����տɼ��⣻
��2��Ni����Χ�����Ų�Ϊ3d84s2��3d�ܼ�����2��δ�ɶԵ��ӣ�
��3��CO��λʱ���ṩ̼ԭ���ϵ�һ�Թ¶Ե��ӣ�CO��C��O��������ϣ�
��4��ABm���ӻ����͵��жϣ�
����ԭ�ӵ��ӶԼ��㹫ʽ�����Ӷ���n= ������ԭ�ӵļ۵�����+��λԭ�ӵijɼ����������������
������ԭ�ӵļ۵�����+��λԭ�ӵijɼ����������������
ע�⣺�ٵ�������ʽ�е����Ϊ��ֵʱȡ�������������Ϊ��ֵʱȡ��+����
�ڵ���λԭ��Ϊ��ԭ�ӻ���ԭ��ʱ���ɼ�������Ϊ�㣮
����nֵ�ж��ӻ����ͣ�һ�������¹��ɣ���n=2��sp�ӻ���n=3��sp2�ӻ���n=4��sp3�ӻ���sp3�ӻ��������幹�ͣ�sp2�ӻ������ӳ�ƽ�������Σ�
�⣺��1��a��������û�з����Ժͱ����ԣ���A����
b���������ǽ��������Ӻ����ɵ��Ӽ������ã���B��ȷ��
c��������������Ϊ���ɵ�������ӵ糡�����·��������ƶ�����C����
d���������й�������Ϊ���ɵ����ܹ����տɼ��⣬��D����
�ʴ�Ϊ��b��
��2��Ni����Χ�����Ų�Ϊ3d84s2��3d�ܼ�����2��δ�ɶԵ��ӣ��ڶ�������δ�ɶԵ�����Ϊ2��Ԫ����C��O������C�ĵ縺��С���ʴ�Ϊ��c��
��3������ԭ�Ӽ۵������������ṩ��������֮��Ϊ18������ԭ����Ni���۵����Ų�3d84s2����10�����ӣ�CO��λʱ���ṩ̼ԭ���ϵ�һ�Թ¶Ե��ӣ�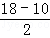 =4��CO��C��O��������ϣ�����1���Ҽ���2���м����ʴ�Ϊ��4��1��2��
=4��CO��C��O��������ϣ�����1���Ҽ���2���м����ʴ�Ϊ��4��1��2��
��4���״�������C�ijɼ����Ӷ���Ϊ4���µ��Ӷԣ��ӻ�����Ϊsp3����������ṹ����ȩ�����е�̼��ȡsp2�ӻ�����ƽ�������νṹ���״�������O��C��H���DZȼ�ȩ������O��C��H����С���ʴ�Ϊ��sp3��С�ڣ�
���������⿼���������������������ʵĹ�ϵ��ԭ�ӹ���ӻ���ʽ���ӻ������жϡ����ܡ����������Ǽ���Ӧ�õȣ��ѶȲ���3�����״��㣮
��2��Ni����Χ�����Ų�Ϊ3d84s2��3d�ܼ�����2��δ�ɶԵ��ӣ�
��3��CO��λʱ���ṩ̼ԭ���ϵ�һ�Թ¶Ե��ӣ�CO��C��O��������ϣ�
��4��ABm���ӻ����͵��жϣ�
����ԭ�ӵ��ӶԼ��㹫ʽ�����Ӷ���n=
 ������ԭ�ӵļ۵�����+��λԭ�ӵijɼ����������������
������ԭ�ӵļ۵�����+��λԭ�ӵijɼ����������������ע�⣺�ٵ�������ʽ�е����Ϊ��ֵʱȡ�������������Ϊ��ֵʱȡ��+����
�ڵ���λԭ��Ϊ��ԭ�ӻ���ԭ��ʱ���ɼ�������Ϊ�㣮
����nֵ�ж��ӻ����ͣ�һ�������¹��ɣ���n=2��sp�ӻ���n=3��sp2�ӻ���n=4��sp3�ӻ���sp3�ӻ��������幹�ͣ�sp2�ӻ������ӳ�ƽ�������Σ�
�⣺��1��a��������û�з����Ժͱ����ԣ���A����
b���������ǽ��������Ӻ����ɵ��Ӽ������ã���B��ȷ��
c��������������Ϊ���ɵ�������ӵ糡�����·��������ƶ�����C����
d���������й�������Ϊ���ɵ����ܹ����տɼ��⣬��D����
�ʴ�Ϊ��b��
��2��Ni����Χ�����Ų�Ϊ3d84s2��3d�ܼ�����2��δ�ɶԵ��ӣ��ڶ�������δ�ɶԵ�����Ϊ2��Ԫ����C��O������C�ĵ縺��С���ʴ�Ϊ��c��
��3������ԭ�Ӽ۵������������ṩ��������֮��Ϊ18������ԭ����Ni���۵����Ų�3d84s2����10�����ӣ�CO��λʱ���ṩ̼ԭ���ϵ�һ�Թ¶Ե��ӣ�
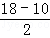 =4��CO��C��O��������ϣ�����1���Ҽ���2���м����ʴ�Ϊ��4��1��2��
=4��CO��C��O��������ϣ�����1���Ҽ���2���м����ʴ�Ϊ��4��1��2����4���״�������C�ijɼ����Ӷ���Ϊ4���µ��Ӷԣ��ӻ�����Ϊsp3����������ṹ����ȩ�����е�̼��ȡsp2�ӻ�����ƽ�������νṹ���״�������O��C��H���DZȼ�ȩ������O��C��H����С���ʴ�Ϊ��sp3��С�ڣ�
���������⿼���������������������ʵĹ�ϵ��ԭ�ӹ���ӻ���ʽ���ӻ������жϡ����ܡ����������Ǽ���Ӧ�õȣ��ѶȲ���3�����״��㣮

��ϰ��ϵ�д�
 ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
�����Ŀ

