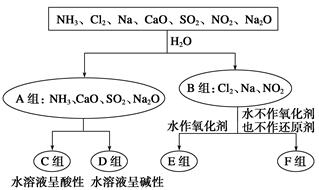
题目内容
下列离子方程式正确的是
| A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH- →CH2ClCOO-+H2O |
C.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: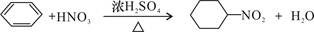 |
| D.用银氨溶液检验乙醛中的醛基: |
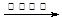 CH3COO-+NH4+ +3NH3+2Ag↓+ H2O
CH3COO-+NH4+ +3NH3+2Ag↓+ H2O
D
解析试题分析:A、实验室用大理石与醋酸反应制取二氧化碳,醋酸为弱电解质,在离子方程式中应用化学式表示,错误;B、氯乙酸与氢氧化钠溶液共热发生卤代烃的水解反应和中和反应,错误; C、苯与浓硫酸、浓硝酸的混合液共热制硝基苯,硝基苯的结构应为硝基和苯环相连,错误;D、用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]++2OH-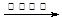 CH3COO-+NH4+ +3NH3+2Ag↓+ H2O,正确。
CH3COO-+NH4+ +3NH3+2Ag↓+ H2O,正确。
考点:考查化学用语及相关物质的结构与性质。

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
常温下,下列各组离子可能大量共存的是 ( )
| A.pH=7的溶液:Fe3+、NH4+、Cl-、NO3- |
| B.pH=2的溶液:Fe2+、Al3+、Cl-、NO3- |
| C.能使甲基橙显黄色的溶液:Cl-、CO32-、K+、AlO2- |
| D.与铝反应产生大量氢气的溶液:[Ag(NH3)2]+、Na+、CH3COO-、NH4+ |
下列各组离子中,能大量共存且形成无色透明溶液的是
| A.Mg2+、H+、C1-、OH- | B.Na+、Ba2+、C1-、NO3- |
| C.Na+、H+、Cl-、CO32- | D.K+、Cu2+、NO3-、SO42- |
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4 2H2SO4 |
B.热的纯碱溶液可以清洗油污的原因: +2H2O +2H2O H2CO3+2OH¯ H2CO3+2OH¯ |
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH¯=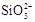 +H2O +H2O |
| D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ ClO-+2H+= Cl2↑+ H2O |
某含Na+的溶液中可能含有NH4+、Fe3+、Br—、CO32—、I—、SO32—。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有
| A.取样,滴加硫氰化钾溶液 |
| B.取样,加氯水和CCl4,振荡 |
| C.取样,加足量盐酸加热,湿润的品红试纸检验气体 |
| D.取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体 |
下列反应的离子方程式中正确的是
| A.氯气与水反应: Cl2 + H2O= 2H++Cl- +ClO- |
| B.氯气通入氢氧化钠溶液中:2Cl2 + 2OH- =3Cl-+ClO- +H2O |
| C.氯化亚铁溶液中滴加过量新制氯水:2Fe2+ +Cl2 = 2Fe3+ + 2Cl- |
| D.少量碳酸钙固体加入足量稀盐酸中:CO32- +2H+ = CO2↑ + H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.在pH=1的溶液中:K+、Na+、SO42–、HCO3- |
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO 、SO42– 、SO42– |
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH 、I-、SCN- 、I-、SCN- |
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO |
下列离子方程式正确的是
| A.乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O |
| C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O →2C6H5OH+CO32— |
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-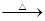 CO32—+2NH4++4Ag↓+6NH3+2H2O CO32—+2NH4++4Ag↓+6NH3+2H2O |