题目内容
某含Na+的溶液中可能含有NH4+、Fe3+、Br—、CO32—、I—、SO32—。取样,滴加足量氯水,有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有
| A.取样,滴加硫氰化钾溶液 |
| B.取样,加氯水和CCl4,振荡 |
| C.取样,加足量盐酸加热,湿润的品红试纸检验气体 |
| D.取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体 |
D
解析试题分析:根据题意知,取样,滴加足量氯水,有气泡产生,说明含有CO32—,反应的离子方程式为:CO32—+2H+=H2O+CO2↑,溶液中Fe3+与CO32—发生水解相互促进的反应不能大量共存,则溶液中不存在Fe3+;溶液呈橙色说明含有Br—,反应的离子方程式为2Br—+Cl2=Br2+2Cl-;向橙色溶液中加BaCl2溶液或淀粉均无现象,证明不含有SO32—、I—。若含有SO32—,会发生反应SO32—+Cl2+ H2O= 2Cl-+SO42—+2H+;SO42—+Ba2+=BaSO4↓;2I—+Cl2=I2+2Cl-,I2与淀粉变蓝色。根据上述分析可知:原溶液一定含有Br—、CO32—,一定不含有Fe3+、I—、SO32—,不能确定的离子是NH4+。为确定该溶液的组成,即确定是否含有NH4+,应该再进行的实验是取样,加足量的熟石灰加热,湿润的红色石蕊试纸检验气体,选D。
考点:考查离子的鉴定、溶液成分的确定。

 名校课堂系列答案
名校课堂系列答案胶体是一种重要的分散系。
(1)制备Fe(OH)3胶体是向煮沸的蒸馏水中逐滴加入 溶液,继续煮沸至 ,停止加热。
(2)向Fe(OH)3胶体中加入某种溶液,出现沉淀,继续滴加该溶液后沉淀溶解。滴入的溶液可能是 。
| A.NaOH溶液 | B.稀H2SO4 | C.Na2SO4溶液 | D.乙醇溶液 |
常温下,在指定环境中,下列各组离子一定不可以大量共存的是 ( )
| A.使pH试纸呈红色或蓝色的溶液:ClO4—、SO42—、Na+ |
| B.使酚酞变红色的溶液:K+、SO32—、CO32—、SO42— |
| C.透明的溶液:Cu2+、Al3+、SO42—、Cl— |
| D.加入铝粉后产生大量氢气的溶液:NH4+、Na+、NO3—、SO42— |
能正确表示下列反应的离子方程式是
| A.钠与水反应:Na+2H2O=Na++OH-+H2↑ |
| B.Kl溶液中滴入稀硫酸,空气中振荡:4H+ +41-+O2=2I2+2H2O |
| C.CuCl2溶液中加入氨水:Cu2+ +20H- = Cu(OH)2:↓ |
D.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-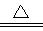 NH3↑+H2O NH3↑+H2O |
下列离子方程式正确的是
| A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH- →CH2ClCOO-+H2O |
C.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: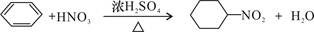 |
| D.用银氨溶液检验乙醛中的醛基: |
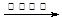 CH3COO-+NH4+ +3NH3+2Ag↓+ H2O
CH3COO-+NH4+ +3NH3+2Ag↓+ H2O 某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是 ( )
| A.Al3+、NO3―、K+、SO42ˉ | B.Ca2+、H+、CO32ˉ、AlO2― |
| C.OHˉ、SO42ˉ、NH4+、Al3+ | D.Fe3+、Mg2+、NO3ˉ、Clˉ |
下列方程式书写正确的是( )
A.碳酸的电离方程式:H2CO3 2H+ + CO32- 2H+ + CO32- |
| B.向氯化钙溶液中通入二氧化硫气体:Ca2+ + SO2 + H2O = CaSO3 ↓+ 2H+ |
| C.往AgI悬浊液中滴加Na2S饱和溶液: 2Ag+ (aq)+ S2-(aq) = Ag2S(s) |
D.明矾水解:Al3+ + 3H2O  Al(OH)3+ 3H+ Al(OH)3+ 3H+ |
下列说法正确的是( )
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O |
| B.将10mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中,c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) |
| C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) |
| D.将10mL 0.1 mol.L-1 KAl(SO4)2溶液和10 mL 0.2 mol.L-1 Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
下列离子方程式不正确的是 


| A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=Cl-+2H++SO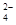 |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++2HCO 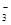 +4OH-=Mg(OH)2 ↓+2CO +4OH-=Mg(OH)2 ↓+2CO +2H2O +2H2O |
| D.在过氧化钠中加入稀硫酸:2Na2O2+4H+=4Na++2H2O+O2↑ |