题目内容
【题目】铬元素的+6价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:

已知:Fe3+完全沉淀[c(Fe3+)≤1.0×10-5mol·L-1时pH为3.6。
回答下列问题:
(1)滤渣A的主要成分为___________。
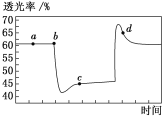
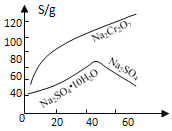
(2)根据右图信息,操作B包含蒸发结晶和___________。
(3)酸化后的Cr2O72-可被SO32-还原,该反应中若有0.5mol Cr2O72-被还原为Cr3+,则消耗SO32-的物质的量为___________mol。
(4)将重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠可以制得工业用粗化液的主要成分CrO3(铬酐),写出该反应的化学方程式______________________。
(5)通过两步反应可以实现Cr(OH)3转化为Cr,若第一步反应为2Cr(OH)3![]() Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
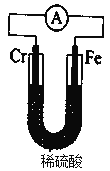
(6)利用如图装置,探究铬和铁的活泼性强弱。能证明铁比铬活泼的实验现象是______________________。工业上,在钢器具表面镀铬以增强器具的抗腐蚀性能,用硫酸铬[Cr2(SO4)3]溶液作电解液,阴极的电极反应式为______________________。
【答案】Fe(OH)3 趁热过滤 1.5mol Na2Cr2O7+2H2SO4(浓) ![]() 2NaHSO4+2CrO3+H2O Cr2O3+2Al
2NaHSO4+2CrO3+H2O Cr2O3+2Al ![]() Al2O3+2Cr Cr电极上产生气泡,溶液颜色变为浅绿色 Cr3++3e-=Cr
Al2O3+2Cr Cr电极上产生气泡,溶液颜色变为浅绿色 Cr3++3e-=Cr
【解析】
(1)加入NaOH至溶液的pH=3.6时Fe3+形成Fe(OH)3沉淀进入滤渣A中;
(2)根据物质的溶解度与温度变化关系采用高温过滤分离Na2SO4、Na2Cr2O7;
(3)根据在溶液中 Cr2O72-、SO32-发生氧化还原反应,电子得失数目相等计算;
(4)重铬酸钠与浓硫酸在加热时反应产生硫酸氢钠、CrO3和水,根据原子守恒配平方程式;
(5)Cr2O3与Al在高温下发生置换反应,产生Cr与Al2O3,根据电子守恒、原子守恒配平方程式;
(6)利用原电池反应原理,比较金属的活泼性,活动性强的为负极,失去电子,发生氧化反应;活动性弱的为正极,正极上发生还原反应;在电镀时,镀件钢器具作阴极,发生还原反应。
(1)铬渣中含有Na2SO4及少量Cr2O72-、Fe3+,先水浸,然后向其中加入稀的NaOH溶液,调整pH=3.6,这时Fe3+完全转化为Fe(OH)3沉淀进入滤渣A中,故滤渣A主要成分是Fe(OH)3;
(2)将滤渣A过滤除去后溶液中含有Na2SO4、Na2Cr2O7,将溶液蒸发浓缩,根据物质的溶解度曲线可知:Na2Cr2O7的溶解度随温度的升高而增大,Na2SO410H2O的溶解度先是随温度的升高而增大,当温度接近50℃时,Na2SO4的溶解度随温度的升高而减小,趁热过滤,就可以使Na2SO4过滤除去,得到的母液中主要含有Na2Cr2O7;因此操作是蒸发浓缩、趁热过滤;
(3)酸化后的Cr2O72-可被SO32-还原,根据电子得失数目相等可知,若该反应中有0.5mol Cr2O72-被还原为Cr3+,转移电子的物质的量为n(e-)=0.5mol×2×(6-3)=3mol,由于SO32-被氧化为SO42-,每1mol SO32-失去2mol电子,所以消耗SO32-的物质的量n(SO32-)=3mol÷2=1.5mol;
(4)重铬酸钠与浓硫酸在加热时反应产生硫酸氢钠、CrO3和水,根据反应前后各种元素的原子守恒,可得反应方程式:Na2Cr2O7+2H2SO4(浓)![]() 2NaHSO4+2CrO3+H2O;
2NaHSO4+2CrO3+H2O;
(5)Cr2O3与Al在高温下发生置换反应,产生Cr与Al2O3,根据电子守恒、原子守恒配平方程式为:Cr2O3+2Al ![]() Al2O3+2Cr;
Al2O3+2Cr;
(6)若要利用原电池反应原理,证明铁比铬活泼,可以将二者连接起来,放入稀H2SO4中,在Fe电极上发生反应:Fe-2e-=Fe2+,进入溶液,使溶液变为浅绿色;电子经过导线转移至金属Cr上,溶液中的H+在Cr上获得电子,发生还原反应:2H++2e-=H2↑,在Cr电极上有许多气泡产生。因此看到实验现象是:溶液颜色变为浅绿色,同时在Cr电极上有许多气泡产生;在钢器具表面镀铬,要使钢器具与外接电源的负极连接,作阴极,发生还原反应:Cr3++3e-=Cr,使钢铁表面覆盖一层金属铬,抗腐蚀能力大大增强。

 黄冈创优卷系列答案
黄冈创优卷系列答案