题目内容
已知常温常压和催化剂条件下,N2(g)和H2(g)生成2 mol NH3(g)放出92.4 kJ的热量。在上述条件下向密闭容器中通入1 mol N2和3 mol H2,达到平衡时放出热量为Q1 kJ;向另一体积相同的容器中通入0.9 mol N2、2.7 mol H2和0.2 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是( )
| A.2Q=Q1="92.4" | B.Q2<Q1<92.4 |
| C.Q1<Q2<92.4 | D.Q1=Q2=92.4 |
B
根据题意,每生成2 mol NH3放出92.4 kJ热量,1 mol N2和3 mol H2反应,达到平衡态,生成NH3小于2 mol,故放出热量小于92.4 kJ;另一容器中通入0.9 mol N2、2.7 mol H2和0.2 mol NH3,相同条件下达到平衡时与上述平衡是等效平衡,但由于充入了NH3,所以N2和H2反应生成的NH3比上述平衡少,故有Q2<Q1<92.4。

练习册系列答案
相关题目
 H2+I2(g)(正反应为放热反应),在此系统趋向平衡状态的过程中,下列说法正确的是( )
H2+I2(g)(正反应为放热反应),在此系统趋向平衡状态的过程中,下列说法正确的是( ) 2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积分数为10%,下列推断正确的是( )
2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积分数为10%,下列推断正确的是( ) C(g)+2D(g),平衡时C的含量为m%。其他条件不变,按下列配比将物质放入容器中,达平衡时,C的含量仍为m%的是( )
C(g)+2D(g),平衡时C的含量为m%。其他条件不变,按下列配比将物质放入容器中,达平衡时,C的含量仍为m%的是( )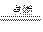 2H2O与2H2O
2H2O与2H2O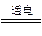 2H2↑+O2↑
2H2↑+O2↑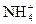 +OH-
+OH-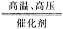 3H2+N2与N2+3H2
3H2+N2与N2+3H2 2NH3
2NH3 2SO3与2SO3
2SO3与2SO3 H2↑+I2↑与H2+I2
H2↑+I2↑与H2+I2 2NH3达到平衡,下列说法正确的是( )
2NH3达到平衡,下列说法正确的是( )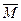 不随时间变化
不随时间变化 2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。
2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。 CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则