题目内容
【题目】N2H4通常用作火箭的高能燃料,N2O4作氧化剂.请回答下列问题:
(1)已知:N2(g)+2O2(g)═2NO2(g)△H=+a kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣b kJ/mol
2NO2(g)N2O4(g)△H=﹣c kJ/mol
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式 .
(2)N2、H2合成氨气为放热反应.800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2 , 甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡.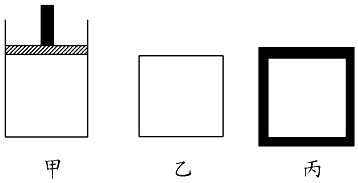
①达到平衡时,平衡常数K甲K乙K丙(填“>”、“<”或“=”).
②达到平衡时N2的浓度c(N2)甲c(N2)乙,c(N2)乙c(N2)丙(填“>”、“<”或“=”).
③对甲、乙、丙三容器的描述,以下说法正确的是 .
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态.
【答案】
(1)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=﹣(a﹣c+2b)kJ/mol
(2)=,>,>,<,CD
【解析】解:(1)由①N2(g)+2O2(g)═2NO2(g)△H=+akJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣b kJ/mol
③2NO2(gN2O4(g)△H=﹣ckJ/mol
根据盖斯定律可知②×2﹣①﹣③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=﹣(a﹣c+2b)kJ/mol;
(2)①甲乙容器温度不变,平衡常数不变,丙容器绝热,温度升高平衡逆向进行,平衡常数减小,故K甲=K乙>K丙;
②甲容器在反应过程中保持压强不变,故容器体积减小,氮气的浓度增大;乙容器保持体积不变,随着反应的进行,压强减小;丙容器绝热,温度升高平衡逆向进行,故达到平衡时N2的浓度c(N2)甲>c(N2)乙<c(N2)丙;
③A.总质量一定,体积一定,故乙容器气体密度不再变化时,不能说明此反应已达到平衡状态,A不符合题意;
B.在甲中充入稀有气体He,体积增大,原体系的压强减小,化学反应速率减慢,B不符合题意;
C.向甲容器中冲入氨气,体积增大,氢气和氮气的浓度减小,氨气的浓度增大,故正向速率减小,逆向速率增大,C符合题意;
D.丙容器绝热,故丙容器温度不再变化时说明已达平衡状态,D不符合题意;
所以答案是:(1)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=﹣(a﹣c+2b)kJ/mol;(2)①=,>;②>,<;③CD.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ. 向铝灰中加入过量稀H2SO4,过滤;
Ⅱ. 向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ. 加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ. 加入MnSO4至紫红色消失,过滤;
Ⅴ. 加热浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是__________________。
(2)KMnO4氧化Fe2+的离子方程式补充完整:_________________

(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的_______________;
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________。
②Ⅳ中加入MnSO4的目的是_____________________。