题目内容
下列有关说法正确的是
| A.0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br 、I的非金属性递增的规律 |
C.2SO2(g)+O2(g)  2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 |
| D.室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
D
试题分析:A、0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明升高温度促进碳酸钠的水解,升高温度,平衡向吸热反应方向移动,则盐类水解反应是吸热反应,错误;B、元素的非金属性强弱与元素气态氢化物的酸性强弱无关,错误;C、2SO2(g)+O2(g)
 2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)增大,但平衡不移动,SO2转化率不变,错误;D、根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大知,室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明碳酸的酸性大于硅酸,非金属性C>Si,正确。
2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)增大,但平衡不移动,SO2转化率不变,错误;D、根据盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大知,室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明碳酸的酸性大于硅酸,非金属性C>Si,正确。
练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目

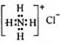
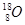
 Bi和
Bi和 Bi的说法正确的是( )
Bi的说法正确的是( )