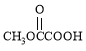题目内容
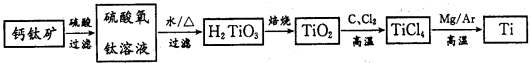
【题目】I. 钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为___________晶体。
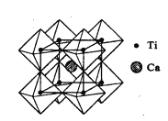
(2)钙钛矿晶体的结构如图所示。钛离子位于立方晶胞的角顶,被____个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被____个氧离子包围。
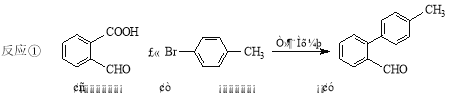
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下:
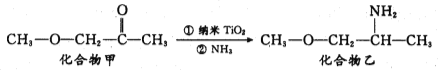
化合物甲中C原子的杂化方式为_______________;化合物乙的沸点明显高于化合物甲,主要原因是_______________________________。
II. 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(4)镍元素在元素周期表中的位置为 。
(5)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(6)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O—C—H键角______(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
(7)Ni的氯化物与氨水反应可形成配合物[Ni(NH3)4]Cl2,2mol该配合物中含有σ键______mol。
【答案】(1)分子 (2)6 12
(3)sp2和sp3 化合物乙分子间形成氢键
(4)第4周期第VIII族(5)> (6)小于(7)32
【解析】
试题分析:I.(1)TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,可知TiCl4为分子晶体。
(2)根据钙钛矿晶体的结构知钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围。
(3)根据有机物甲的结构简式知化合物甲中C原子的杂化方式为sp2、sp3;化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键。
II.(4)镍元素为28号元素,在元素周期表中的位置为第4周期第VIII族。
(5)NiO、FeO的晶体结构类型相似,离子半径:Ni2+<Fe2+,晶格能:NiO>FeO,则熔点NiO>FeO。
(6)甲醛(H2C=O)分子中碳原子的杂化方式为sp2杂化,甲醇(CH3OH)分子氧原子的杂化方式为sp3杂化,则甲醇分子内的O—C—H键角小于甲醛分子内的O—C—H键角。
(7)配合物[Ni(NH3)4]Cl2中含有14个σ键,则2mol该配合物中含有σ键28mol。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 发生装置 |
① | 制氧气 | H2O2→O2 | |
② | 制氨气 | NH4Cl→NH3 | |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是______________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是___________,写出实验室制取该气体的化学方程式
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。
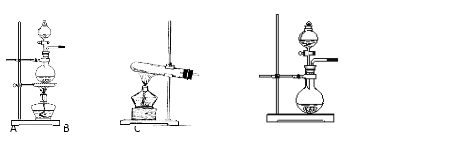
(3) 若用上述制备O2的装置制备NH3,则选择的试剂为____________________。
(4) 制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为 mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次