题目内容
【题目】ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常为+3价,这些化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)镓元素(Ga)的原子序数为__________,其外围电子排布式__________。
(2)由第二周期元素组成的与BCl3互为等电子体的阴离子为________。 硼元素具有缺电子性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—。不考虑空间构型,[B(OH)4]—中原子的成键方式用结构简式表示为______________。1 mol [B(OH)4]—中σ键的数目为________。
(3)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因______________。
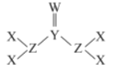
(4)磷化铝熔点为2000℃,空间结构与金刚石相似,磷化铝晶胞结构如图所示。
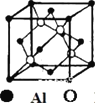
①磷化铝晶体中磷与铝微粒间的作用力为__________。
②磷化铝晶体的密度为ρ g·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为__________cm。
【答案】31 4s24p1 CO32或NO3 ![]() 8NA GaF3为离子晶体,GaCl3为分子晶体 (极性)共价键
8NA GaF3为离子晶体,GaCl3为分子晶体 (极性)共价键 ![]() ×
×![]()
【解析】
(1)镓是31号元素,核外有31个电子,基态镓(Ga)原子的电子排布式为1s22s22p63s23p63d104s24p1,外围电子排布式为4s24p1;
(2)等电子体原子个数相等、价电子数相等,由第二周期元素组成的与BCl3互为等电子体的阴离子为CO32或NO3;[B(OH)4]-中B原子与O原子之间形成4个共价键,其中1个为配位键,用结构简式表示为![]() ;1个[B(OH)4]-中含有4个氢氧键和4个硼氧键,则其中含有8个σ键,1mol[B(OH)4]-中含有σ键的数目为8NA;
;1个[B(OH)4]-中含有4个氢氧键和4个硼氧键,则其中含有8个σ键,1mol[B(OH)4]-中含有σ键的数目为8NA;
(3)离子晶体熔沸点较高、分子晶体熔沸点较低,GaF3为离子晶体,GaCl3为分子晶体,所以前者沸点高于后者;
(4)①磷化铝晶体中磷与铝的电负性差小于1.8,形成的是共价键,且为极性的,因此磷化铝晶体中磷与铝微粒间的作用力为(极性)共价键;
②立方晶胞顶点粒子占![]() ,面粒子占
,面粒子占![]() ,晶胞内部原子为整个晶胞所有,因此一个晶胞中含有Al的个数为8×
,晶胞内部原子为整个晶胞所有,因此一个晶胞中含有Al的个数为8×![]() +6×
+6×![]() =4,含有P的个数为4,化学式为AlP。晶胞参数为acm,则一个晶胞的体积为V=a3cm3,因此晶胞的密度为ρ=
=4,含有P的个数为4,化学式为AlP。晶胞参数为acm,则一个晶胞的体积为V=a3cm3,因此晶胞的密度为ρ=![]() g/cm3,则晶胞参数a=
g/cm3,则晶胞参数a=![]() cm,根据立体几何知识,不难求出两个Al原子之间最短的距离为面对角线的一半,即为
cm,根据立体几何知识,不难求出两个Al原子之间最短的距离为面对角线的一半,即为![]() a=
a=![]() ×
×![]() cm。
cm。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D