题目内容
短周期A、B、C三种元素原子序数依次递增,它们的原子最外层电子数之和为11,A、C同主族,B原子最外层电子数比A原子次外层电子数多1.下列叙述正确的是( )
分析:短周期A、B、C三种元素原子序数依次递增,它们的原子最外层电子数之和为11,A、C同主族,设A的最外层电子数为x,则C的最外层电子数为x,B原子最外层电子数比A原子次外层电子数多1,则A的次外层为2,即B的最外层电子数为3,所以x+x+3=11,解得x=4,即A为C,B为Al,C为Si,然后利用元素及其单质、化合物的性质来解答.
解答:解:短周期A、B、C三种元素原子序数依次递增,它们的原子最外层电子数之和为11,A、C同主族,设A的最外层电子数为x,则C的最外层电子数为x,B原子最外层电子数比A原子次外层电子数多1,则A的次外层为2,即B的最外层电子数为3,所以x+x+3=11,解得x=4,即A为C,B为Al,C为Si,
A.氧化铝为离子晶体,二氧化碳为分子晶体,则氧化铝的熔点高,故A错误;
B.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为B>C>A,故B正确;
C.B的最高价氧化物的水化物为氢氧化铝,属于两性氢氧化物,故C错误;
D.A元素存在同素异形体,如金刚石、石墨,而B不存在同素异形体,故D错误;
故选B.
A.氧化铝为离子晶体,二氧化碳为分子晶体,则氧化铝的熔点高,故A错误;
B.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为B>C>A,故B正确;
C.B的最高价氧化物的水化物为氢氧化铝,属于两性氢氧化物,故C错误;
D.A元素存在同素异形体,如金刚石、石墨,而B不存在同素异形体,故D错误;
故选B.
点评:本题考查位置、结构、性质,元素的推断是解答本题的关键,熟悉元素及其化合物的性质即可解答,题目难度不大.

练习册系列答案
相关题目
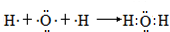 (含有2个σ键)
(含有2个σ键)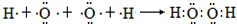 (含有3个σ键)
(含有3个σ键) (离子键)
(离子键)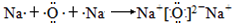
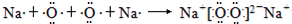 (离子键或离子键、共价键其中含有1个σ键)
(离子键或离子键、共价键其中含有1个σ键)