题目内容
CO与H2的分子个数比为1∶4的混合气体共2.1g,与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
A.2.1g B.3.6g C.7.2g D.不可求
【答案】
A
【解析】
试题分析:CO和氢气燃烧后分别生成CO2和水,然后再和过氧化钠反应又生成氧气,所以总的方程式可以看作是H2+Na2O2=2NaOH、CO+Na2O2=Na2CO3。因此过氧化钠增加的质量就是氢气和CO的质量,所以答案选A。
考点:考查过氧化钠的有关计算
点评:该题的关键是依据反应的方程式得出过氧化钠增加的质量就是原气体的质量。如果进一步拓展,则凡是符合(CO)n(H2)m的完全燃烧后再和过氧化钠反应,过氧化钠增加的质量就是原物质的质量。

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
燃烧热是指在101 kPa时,1 mol 物质完全燃烧生成稳定的氧化物时放出的热量。某发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种。已知常温下A、B及CO、H2的燃烧热如下:
物质 | A | B | CO | H2 |
燃烧热/kJ·mol-1 | 725 | 5 518 | 283 | 286 |
A、B按不同比例混合的燃料有91.2 g,在足量的O2中燃烧时,放出的热量Q与B的物质的量分数x的关系如下图所示。
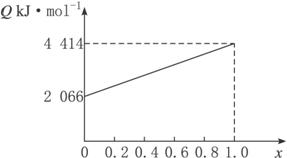
(1)求A、B的相对分子质量。
(2)等物质的量A、B混合的燃料有73 g,在160 L O2中完全燃烧,得到104 L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定)。由此可推得混合物中原子个数比N(C)∶N(H)∶N(O)是多少?写出A和B的化学式。
(3)求1 mol由A、B等物质的量混合而成的燃料在一定的氧气中燃烧,放出2 980 kJ的热量,则反应中生成CO的物质的量。
CO与H2的分子个数比为1∶4的混合气体共2.1g,与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加
| A.2.1g | B.3.6g | C.7.2g | D.不可求 |
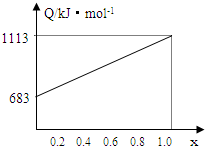 某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种.已知甲、乙及CO、H2的燃烧热如下:
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种.已知甲、乙及CO、H2的燃烧热如下: