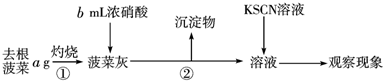
题目内容
某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示,下列有关说法不正确的是

- A.开始时溶液pH=2是因为残留液中还有盐酸剩余
- B.AB段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加
- C.BC段发生的反应为:Ca2++CO32-= CaCO3↓
- D.滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+)
B
试题分析: A、残留液起始的pH接近于2,说明溶液中有盐酸剩余,正确;B、图像中的纵坐标表示的是pH的变化,不是沉淀的质量,错误;C、BC段时,残留液中盐酸已消耗完,再滴入碳酸钠溶液,发生反应Ca2++CO32-=CaCO3,此时pH不发生变化,正确;D、D点时,对应溶液pH大于7,正确。
考点:考查图像分析。
试题分析: A、残留液起始的pH接近于2,说明溶液中有盐酸剩余,正确;B、图像中的纵坐标表示的是pH的变化,不是沉淀的质量,错误;C、BC段时,残留液中盐酸已消耗完,再滴入碳酸钠溶液,发生反应Ca2++CO32-=CaCO3,此时pH不发生变化,正确;D、D点时,对应溶液pH大于7,正确。
考点:考查图像分析。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
在一密闭容器中有如下反应:aX (g)+bY(g)?nW(g);△H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
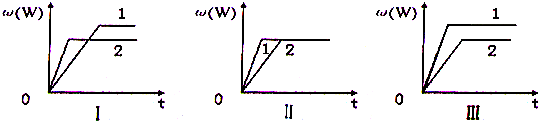
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析不正确的是( )
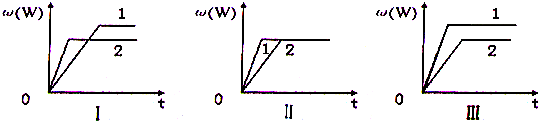
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析不正确的是( )
| A、图I可能是不同压强对反应的影响,且p2>p1,a+b<n | B、图II可能是不同压强对反应的影响,且p1>p2,n<a+b | C、图II可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 | D、图Ⅲ可能是不同温度对反应影响,且T1>T2,△H>0 |