【题目】己二酸是一种重要的化工原料和合成中间体。已知:室温下,己二酸微溶于水,当温度由28℃升至78℃时,其溶解度可增大20倍。某实验小组利用绿色氧化剂H2O2氧化环己烯合成己二酸,反应和制备装置如下:
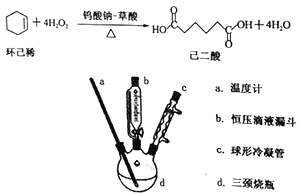
主要实验步骤:
①在100mL三颈烧瓶中依次加入1.50g钨酸钠0.57g草酸和34mL30%过氧化氢溶液,室温下磁力搅拌20min。
②用恒压滴液漏斗缓慢加入8.0mL的环己烯,继续搅拌并加热回流2小时,停止加热。
③将反应液迅速转入烧杯中,冷却至室温后再用冰水浴冷却,有大量晶体析出。抽滤,并用少量冰水洗涤,即可得到己二酸晶体粗品。
回答下列问题:
(1)本实验中使用带刻度的恒压滴液漏斗的主要作用有_________、_________。
(2)步骤③中用冰水洗涤晶体的目的是______________________________________。
己二酸晶体粗品可利用_________方法进一步获得纯品。
(3)取0.1480g己二酸(Mr=146.0)样品置于250mL锥形瓶中,加入50mL蒸馏水溶解,再加入2滴指示剂,用0.1000mol/Ld的NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为20.00mL。
①本实验应选择_________(填“甲基橙”“石蕊”或“酚酞”)溶液作指示剂。
②判断滴定终点的方法是_________________________。
③样品中己二酸的质量分数为_________%(保留4位有效数字)。
(4)实验小组通过改变环己烯的用量来探究物料比对产率的影响,实验结果如下图所示。
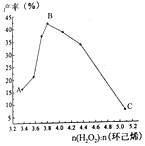
结合图像分析产率变化的可能原因:
①A点→B点:___________________________________________;
②B点→C点:____________________________________________。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案