题目内容
12.在100mL的FeBr2溶液中,通入2.24L的标准状况下的氯气,充分反应后溶液中有$\frac{1}{3}$的Br被氧化成溴单质,求原FeBr2溶液的物质的量浓度.分析 还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,根据n=$\frac{V}{{V}_{m}}$计算氯气的物质的量,令原溶液中FeBr2的物质的量为amol,利用电子转移守恒计算a的值,再根据c=$\frac{n}{V}$计算原FeBr2溶液的物质的量浓度.
解答 解:标准状况下2.24L氯气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,令原溶液中FeBr2的物质的量为amol,根据电子转移守恒,则:
amol×(3-2)+$\frac{1}{3}$×2×amol×[0-(-1)]=0.1mol×2,
解得a=0.12,
故原FeBr2溶液的物质的量浓度$\frac{0.12mol}{0.1L}$=1.2mol/L,
答:原FeBr2溶液的物质的量浓度为:1.2mol/L.
点评 本题考查物质的量浓度有关计算、氧化还原反应的有关计算,难度中等,判断离子的还原性强弱,结合电子转移守恒计算是关键.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
3.已知丙二醇的结构简式为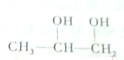 ,下列关于丙二醇的说法正确的是( )
,下列关于丙二醇的说法正确的是( )
 ,下列关于丙二醇的说法正确的是( )
,下列关于丙二醇的说法正确的是( )| A. | 丙二醇可发生消去反应生成丙炔 | |
| B. | 丙二醇可由丙烯在一定条件下与水加成制得 | |
| C. | 丙烯与溴水加成后,再与NaOH醇溶液共热水解可得丙二醇 | |
| D. | 丙二醇在铜存在下催化氧化可得到丙二醛 |
7.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水Al3++4NH3 H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸 CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气 2Fe2++Cl2=2Fe3++2Cl- |
17.Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜:2Cu2O+Cu2S═6Cu+SO2↑.对于该反应,下列说法中正确的是( )
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | Cu2S在反应中既是氧化剂又是还原剂 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 氧化产物和还原产物的物质的量之比为6:1 |
4.下列说法错误的是( )
| A. | 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 | |
| B. | 红外光谱可以完全测定出有机物结构,判断出同分异构体 | |
| C. | 萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作 | |
| D. | 常用质谱法进行有机物相对分子质量的测定 |
1.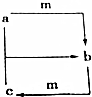 下列各组物质之间通过一步反应不能实现如图所示转化的是( )
下列各组物质之间通过一步反应不能实现如图所示转化的是( )
 下列各组物质之间通过一步反应不能实现如图所示转化的是( )
下列各组物质之间通过一步反应不能实现如图所示转化的是( ) | 选项 | a | b | c | m |
| A | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 | 二氧化碳 |
| B | 硝酸 | 硝酸铁 | 硝酸亚铁 | 铁 |
| C | 硫酸铝 | 氢氧化铝 | 偏铝酸钠 | 氢氧化钠 |
| D | 氮气 | 一氧化氮 | 二氧化氮 | 氧气 |
| A. | A | B. | B | C. | C | D. | D |
2.质量数为27的元素R,其核内有14个中子,则R可形成的离子为( )
| A. | R+ | B. | R2+ | C. | R3+ | D. | R2- |