题目内容
【题目】[化学——选修2:化学与技术]碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2 ;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为____________。
②工业上给原料气加压的方法是________。
(2)操作Ⅰ是________。
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是____________(填化学式)。
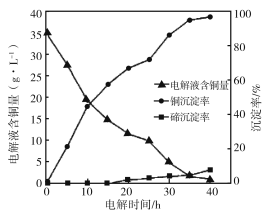
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,Cu2+浓度从7.78 g·L-1下降到1.10 g·L-1。
①TeOSO4生成Te的化学方程式为________。
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是________。
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为________。
【答案】(1)①2Ag2Te+3O2=2Ag2O+2TeO2;②用压缩机加压;
(2)过滤;(3)CuSO4;(4)Cu2++2e—=Cu;
(5)①TeOSO4+2SO2+3H2O=Te+3H2SO4;②NaCl比KI价格便宜;③98.5%
【解析】
试题分析:(1)①根据Cu2Te与氧气反应的方程式,Ag2Te与氧气的反应方程方式为:2Ag2Te+3O2=2Ag2O+2TeO2;②用压缩机加压;(2)操作I得到溶液和固体,因此操作步骤是过滤;(3)加压硫酸浸出的反应还发生2Cu+O2+2H2SO4=2CuSO4+2H2O,因此还有CuSO4;(4)根据图像开始时,电解液中含铜量减少,铜沉淀率增加,因此电解开始时,阴极上发生Cu2++2e-=Cu;(5)①根据流程图,Te的化合价由+4价→0价,化合价降低,则SO2中S的化合价升高,根据化合价升降法进行配平,反应方程式为:TeOSO4+2SO2+3H2O=Te+3H2SO4;②NaCl比KI价格便宜;③还原率利用浓度变化进行计算,还原率为(6.72-0.1)/6.72×100%=98.5%。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】
(1)下列关于实验的叙述中正确的有__________。
A.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
B.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
C.使用分液漏斗前要检查其是否漏水 |
D.用托盘天平称量物质质量时,物品应置于右盘 |
E.可燃性气体点燃前一定要验纯
F.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
(2)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

①从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);
分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置__________,该分离方法的名称为______________。
②从碘水中分离出I2,选择装置__________,该分离方法的名称为__________,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,碘主要溶解在 (填“上层”或“下层”)液体中,该层溶液颜色为__________。
③装置A中①的名称是__________,进水的方向是从___________(填“上”或“下”)口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作 。

