题目内容
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
【答案】(1)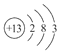 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)16 (3)HCl (4)CO2 (5)25%
【解析】
试题(1)铝元素的质子数是13,所以Al的原子结构示意图为![]() ;金属铝和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
;金属铝和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,30Si的原子的中子数为30-14=16。
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,所以Y是第ⅦA元素。由于氟化氢分子间存在氢键,所以该族氢化物中沸点最低的是HCl。
(4)大理石在高温下分解可以生成CO2,所以使金属不被氧化的气体应该是CO2。
(5)在熔渣中加入盐酸,发生的反应为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,11.0 g为SiO2的质量。在滤液中加入过量NaOH溶液,发生的反应为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,所得21.4 g固体为Fe(OH)3,根据关系式:
2Fe(OH)3~Fe2O3
214 160
21.4 g m
![]()
解得m=16g
由此可知:Al2O3的质量=36.0 g-11.0 g-16.0 g=9.0g,故Al2O3的质量分数=![]() ×100%=25%。
×100%=25%。

【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJmol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3mol-3min-1。

②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。