题目内容
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq)△H1=akJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=bkJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=ckJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=_____kJ·mol-1。
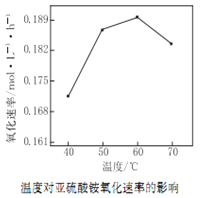
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______。
⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数K=____。[已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________。
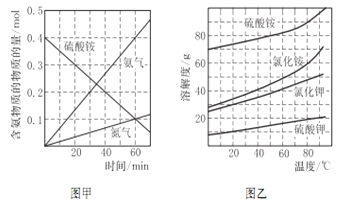
②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________。
【答案】 2a+2b+c 温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低) 3138 2Cu2S+2(NH4)2SO4+5O2![]() 4CuSO4+4NH3+2H2O
4CuSO4+4NH3+2H2O ![]() 配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
【解析】(1)已知:①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=akJ·mol-1 ②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=bkJ·mol-1 ③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=ckJ·mol-1 ,根据盖斯定律:①×2+②×2+③得反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=(2a+2b+c)kJ·mol-1;
(2) (NH4)2SO3受热易分解,(NH4)2SO3为弱酸弱碱盐,水解吸热,气体的溶解度随温度升高而减小,故当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中的溶解度降低);
(3)反应:CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s)的平衡常数![]() ;
;
(4)①Cu2S与硫酸铵混合后在空气中进行焙烧生成硫酸铜和氨气,利用化合价升降法配平,该反应的化学方程式为2Cu2S+2(NH4)2SO4+5O2![]() 4CuSO4+4NH3+2H2O;②分析图甲可知0.4mol硫酸铵在500℃下分解,反应进行到60min时,消耗0.3mol硫酸铵,生成0.4mol氨气和0.1mol氮气,即3mol硫酸铵分解生成4mol氨气和1mol氮气,氮元素的化合价由硫酸氨中的-3价升高到氮气的0价,失去6mol电子,根据电子守恒推出3mol硫酸根中硫元素的化合价由+6价降低为+4价,生成3mol二氧化硫,结合原子守恒推断另一种产物为水;③根据图乙可知相同温度下溶解度:硫酸铵>氯化钾>硫酸钾,则由(NH4)2SO4、KCl为原料制备K2SO4的实验方案为配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶、过滤、洗涤。
4CuSO4+4NH3+2H2O;②分析图甲可知0.4mol硫酸铵在500℃下分解,反应进行到60min时,消耗0.3mol硫酸铵,生成0.4mol氨气和0.1mol氮气,即3mol硫酸铵分解生成4mol氨气和1mol氮气,氮元素的化合价由硫酸氨中的-3价升高到氮气的0价,失去6mol电子,根据电子守恒推出3mol硫酸根中硫元素的化合价由+6价降低为+4价,生成3mol二氧化硫,结合原子守恒推断另一种产物为水;③根据图乙可知相同温度下溶解度:硫酸铵>氯化钾>硫酸钾,则由(NH4)2SO4、KCl为原料制备K2SO4的实验方案为配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶、过滤、洗涤。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数