题目内容
7.下列离子方程式书写正确的是( )| A. | Cu溶于足量浓硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| B. | 氧化亚铁加入稀硝酸中:FeO+2H+=Fe2++H2O | |
| C. | 氨水吸收过量的SO2:OH-+SO2=HSO3- | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
分析 A.反应生成硝酸铜、二氧化氮和水;
B.发生氧化还原反应生成硝酸铁、NO和水;
C.反应生成亚硫酸氢铵,一水合氨在离子反应中保留化学式;
D.醋酸在离子反应中保留化学式.
解答 解:A.Cu溶于足量浓硝酸的离子反应为Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O,故A正确;
B.氧化亚铁加入稀硝酸中的离子反应为3FeO+NO3-+10H+=3Fe3++NO↑+5H2O,故B错误;
C.氨水吸收过量的SO2的离子反应为NH3.H2O+SO2=HSO3-+NH4+,故C错误;
D.碳酸钙溶于醋酸中的离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 粗铜板作阳极,电解硫酸铜溶液 | 粗铜溶解,纯铜在阴极上析出 | Cu 放电是氧化剂 |
| B | 向银氨溶液中滴加几滴乙醛后 水浴加热 | 银附着在试管壁上 | 乙醛发生还原反 应 |
| C | 向含 I-的无色溶液中滴加少量 新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向 FeSO4溶液中先滴入 KSCN 溶液再滴加 H2O2 溶液 | 加入 H2O2后溶液变成血红色 | Fe2+既有氧化性又 有还原性 |
| A. | A | B. | B | C. | C | D. | D |
18.下列有关NA数值的说法正确的是( )
| A. | ag乙烯和丙烯混合物中所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 常温常压下,18g重水中含有的中子数为8NA | |
| C. | 标准状况下,2.24LCl2与足量的铁反应转移的电子数目是0.3NA | |
| D. | 7.8gNa2O2中含有的阴离子数为0.2NA |
15.下列叙述正确的是( )
| A. | 用水稀释0.1 mol/L的氨水,则溶液中$\frac{c(C{H}_{3}.{H}_{2}O)}{c(O{H}^{-})}$增大 | |
| B. | 在等体积等pH 的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸 | |
| C. | pH=3的盐酸和醋酸分别升高相同的温度,pH均不变 | |
| D. | 两种氨水溶液的物质的量浓度分别为C1和C2,pH分别为a和a+1,则C2=10C1 |
2.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
【提出假设】
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4.5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
实验室有下列试剂可供选择:
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
【提出假设】
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4.5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
12.恒温、恒容的条件下对于N2(g)+3H2(g)?2NH3(g)△H<0的反应,达到化学平衡状态的标志为( )
| A. | 混合气体的平均相对分子质量不变 | |
| B. | 混合气体的密度不变 | |
| C. | 断开一个N≡N键的同时有6个N-H键生成 | |
| D. | N2、H2、NH3分子数之比为1:3:2的状态 |
19.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+、Mn${O}_{4}^{-}$、Cl-、${SO}_{4}^{2-}$ | B. | Na+、${CO}_{3}^{2-}$、${SO}_{4}^{2-}$、Cl- | ||
| C. | ${NO}_{3}^{-}$、Na+、${HCO}_{3}^{-}$、Mg2+ | D. | Na+、${NO}_{3}^{-}$、H+、${SO}_{4}^{2-}$ |
16.某同学按如图所示的装置进行电解实验.下列说法正确的是( )
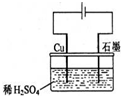

| A. | 电解过程中,石墨电极上始终产生H2 | |
| B. | 电解过程中,石墨电极上始终有铜析出 | |
| C. | 电解过程中,铜电极不断溶解 | |
| D. | 整个电解过程中,溶液PH不断减小 |
13.下列反应方程式中有一个与其他三个在分类上不同,这个反应是( )
| A. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | Na2CO3+CO2+H2O═2NaHCO3 | ||
| C. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O | D. | CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO |