题目内容
20.常温下,1mol化学键分解成气态原子所需要的能量用E表示.、结合表中信息判断下列说法不正确的是( )| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | B. | 表中最稳定的共价键是H-F键 | ||
| C. | H2(g)→2H(g)△H=+436kJ•mol-1 | D. | H2(g)+F2(g)=2HF(g)△H=-25kJ•mol-1 |
分析 A.依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析推断;
B.键能越大形成的化学键越稳定;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断.
解答 解:A.依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析,所以结合图表中数据可知432 kJ•mol-1>E(H-Br)>298 kJ•mol-1,故A正确;
B.键能越大形成的化学键越稳定,表中键能最大的是H-F,最稳定的共价键是H-F键,故B正确;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)?△H=+436 kJ•mol-1 ,故C正确;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436KJ/mol+157KJ/mol-2×568KJ/mol=-543KJ/mol,H2(g)+F2(g)=2HF(g)?△H=-543 kJ•mol-1,故D错误;
故选D.
点评 本题考查了化学反应能量变化和键能的关系分析判断,焓变计算方法是解题 关键,题目难度中等.

练习册系列答案
相关题目
10.下列离子反应中,表达正确的是( )
| A. | 向AlCl3溶液中加入过量氨水:Al3++4 NH3•H2O═AlO2-+4 NH4++2 H2O | |
| B. | 用FeCl3溶液溶解废铜中的铜:2Fe3++3Cu═3Cu2++2 Fe | |
| C. | NaHCO3溶液中滴入过量的Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 铝片溶于过量的氢氧化钠溶液中:Al+4OH-═AlO2-+2H2O |
8.下列分散系能发生丁达尔现象的是( )
| A. | CH3CH2OH水溶液 | B. | 氢氧化铁胶体 | C. | 氯化铁溶液 | D. | 饱和食盐水 |
15.根据下表中提供的键能数据计算反应CH4 (g)+4F2 (g)═CF4+4HF(g)中的能量变化( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155 |
| A. | 放出1940kJ/mol | B. | 吸收1940kJ/mol | C. | 放出485kJ/mol | D. | 吸收485kJ/mol |
5.反应2SO2+O2?2SO3过程中的能量变化曲线如图所示,下列说法中正确的是( )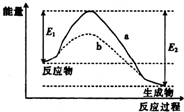

| A. | 由图可知,SO2和O2的总能量一定高于SO3的能量 | |
| B. | 使用正催化剂,E1数值减小 | |
| C. | 曲线b相对曲线a,改变的条件可能是升高温度 | |
| D. | 因该反应为放热反应,故该反应不需要加热 |
12.168O、188O、O2-、O2、O3是( )
| A. | 氧的五种同位素 | B. | 氧元素的五种不同微粒 | ||
| C. | 氧的五种同素异形体 | D. | 五种氧元素 |
