题目内容
(15分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
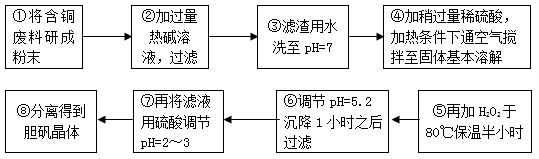
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:

已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
②写出上述工艺中投入氢氧化钠时反应的离子方程式:
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:

已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。
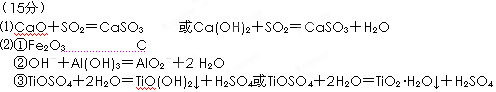
A―CaO B―NaCl C―SiO2 D―Fe2O3 E―TiO2
⑴CaO+SO2=CaSO3 或Ca(OH)2+SO2=CaSO3+H2O
⑵①Fe(OH)3分解生成Fe2O3;C
②Al(OH)3具有两性,能溶于过量的NaOH ,OH-+Al(OH)3=AlO2-+2 H2O
③TiOSO4+2H2O=TiO(OH)2↓+H2SO4
或TiOSO4+2H2O=TiO2·H2O↓+H2SO4

练习册系列答案
相关题目
 。
。 。
。 2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
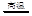 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ; 措施是 ;(填字母代号)
措施是 ;(填字母代号) CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下: 。
。