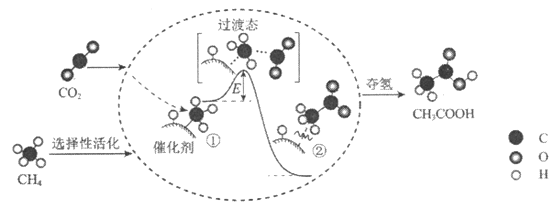
��Ŀ����
����Ŀ�����Ļ�������Ӱ��ֲ�����������������Ҳ�Ǵ�������Ҫ��Ⱦ��֮һ��
(1)�̵�ֱ��Ӱ��������������Ȼ�̵������ķ�Ӧ�У�
��N2(g)+O2(g)=2NO(g) ��H1=+180.5kJ��mol��1
��2NO(g)+O2(g)==2NO2(g) ��H2=��114.1kJ��mo1��l
��N2(g)+2O2(g)=2NO2(g) ��H3=__________kJ ��mol��l��
(2)һ���¶��£��������ʵ�����NO��COͨ��̶��ݻ�Ϊ4L���ܱ������з�����Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)����Ӧ������CO�����ʵ����仯��ͼ����ʾ��
N2(g)+2CO2(g)����Ӧ������CO�����ʵ����仯��ͼ����ʾ��
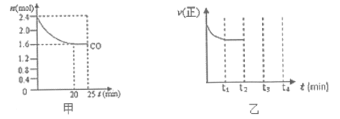
�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����___________(�����)��
A.�����е�ѹǿ����
B.2v��(CO)=v��(N2)
C.�����ƽ����Է����������ֲ���
D.NO��CO������ȱ��ֲ���
��0��20minƽ����Ӧ����v(NO)Ϊ_______mol/(L��min)��
�۷�Ӧ��ƽ������������м���0.4molCO��0.4molCO2�����ʱƽ��______(����������Ӧ�����ƶ����������淴Ӧ�����ƶ����������ƶ���)��
�ܸ÷�Ӧ������Ӧ������ͼ����ʾ����t2ʱ�̣����������ݻ�Ѹ������ԭ����2�����������������������£�t3ʱ�̴ﵽ�µ�ƽ��״̬��������ͼ���У����仭����t2��t4ʱ������Ӧ������ʱ��ı仯���ߡ�_____________��
(3)��������[C3N3(OH)3]��������������β���е�NO2���䷴Ӧ���������С���һ���ǣ�C3N3(OH)3![]() 3HCNO���ڶ�����HCNO��NO2��Ӧ���ѵ�Ԫ�غ�̼Ԫ��ת��������塣��д���ڶ��������Ļ�ѧ��Ӧ����ʽ_________________��
3HCNO���ڶ�����HCNO��NO2��Ӧ���ѵ�Ԫ�غ�̼Ԫ��ת��������塣��д���ڶ��������Ļ�ѧ��Ӧ����ʽ_________________��
(4)�����£���x mol��L��1��ˮ�м���������y mol��L��1����û����ҺMǡ�������ԡ�
��M��Һ����������Ũ���ɴ�С��˳��Ϊ_________________��
�ڳ����£�NH3��H2O�ĵ��볣��K=_______________(�ú�x��y�Ĵ���ʽ��ʾ��������Һ���ǰ�������仯)��
���𰸡�+66.4 AC 0.01 ���淴Ӧ�����ƶ� 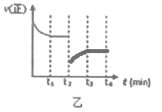 8HCNO+6NO2==7N2+8CO2+4H2O c(NH4+)��c(SO42-)��c(H+)=c(OH-)
8HCNO+6NO2==7N2+8CO2+4H2O c(NH4+)��c(SO42-)��c(H+)=c(OH-) ![]()
��������
(1)���ݸ�˹���ɷ������
(2)��һ���¶��£��������ʵ�����NO��COͨ��̶��ݻ�Ϊ4L���ܱ������з�����Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)������ƽ��ĸ�������������жϣ�
N2(g)+2CO2(g)������ƽ��ĸ�������������жϣ�
�ڸ�������ʽ�������
�۷�Ӧ��ƽ������������м���0.4molCO��0.4molCO2������Qc��K�Ĵ�С��ϵ�����жϣ�
����t2ʱ�̣����������ݻ�Ѹ������ԭ����2������С��ѹǿ�������淴Ӧ���ʾ��Ǽ�С�ģ�ƽ�����淴Ӧ�����ƶ���t3ʱ�̴ﵽ�µ�ƽ��״̬���ݴ˻�ͼ��
(3)�ڶ�����HCNO��NO2��Ӧ���ѵ�Ԫ�غ�̼Ԫ��ת���������Ϊ�����Ͷ�����̼���ݴ���д��Ӧ�Ļ�ѧ����ʽ��
(4)��Һ�����ԣ�c(H+)=c(OH-)���������ˮ������غ�����ж�c(NH4+)��c(SO42-)�Ĵ�С��������
�ڽ�x molL-1�İ�ˮ��ymolL-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c(OH-)=1��10-7mol/L����Һ��c(NH4+)=2c(SO42-)=ymol/L�����֮��Ӧǰc(NH3H2O)=![]() mol/L����Ӧ��c(NH3H2O)=(
mol/L����Ӧ��c(NH3H2O)=(![]() -y)mol/L������K=
-y)mol/L������K=![]() ���㡣
���㡣
(1)��֪����N2(g)+O2(g)=2NO(g)��H1=+180.5kJmol-1����2NO(g)+O2(g)=2NO2(g)��H2=-114.1kJmol-1���ɸ�˹���ɿ�֪����+�ڵã�N2(g)+2O2(g)=2NO2(g)������H=(+180.5kJmol-1)+(-114.14kJmol-1)=+66.4kJmol-1���ʴ�Ϊ��+66.4��
(2)��һ���¶��£��������ʵ�����NO��COͨ��̶��ݻ�Ϊ4L���ܱ������з�����Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��A.��Ӧǰ����������ʵ������ȣ������������ѹǿΪ��������������е�ѹǿ���䣬˵���ﵽ��ƽ��״̬����A��ȷ��B.2v��(CO)=v��(N2)����ʾ�淴Ӧ���ʣ�����Ӧ���ʣ�����ƽ��״̬����B����C. ��Ӧǰ����������ʵ������ȣ���������ƽ����Է����������ٸı䣬˵����������ʵ������䣬�ܹ�˵����ƽ��״̬����C��ȷ��D.���ݷ���ʽ��NO��CO�������ʼ�ձ��ֲ��䣬����˵����ƽ��״̬����D���ʴ�Ϊ��AC��
N2(g)+2CO2(g)��A.��Ӧǰ����������ʵ������ȣ������������ѹǿΪ��������������е�ѹǿ���䣬˵���ﵽ��ƽ��״̬����A��ȷ��B.2v��(CO)=v��(N2)����ʾ�淴Ӧ���ʣ�����Ӧ���ʣ�����ƽ��״̬����B����C. ��Ӧǰ����������ʵ������ȣ���������ƽ����Է����������ٸı䣬˵����������ʵ������䣬�ܹ�˵����ƽ��״̬����C��ȷ��D.���ݷ���ʽ��NO��CO�������ʼ�ձ��ֲ��䣬����˵����ƽ��״̬����D���ʴ�Ϊ��AC��
��һ���¶��£���2.4mol COͨ��̶��ݻ�Ϊ4L���ܱ������У�����ͼ���֪��ƽ��״̬һ����̼���ʵ���Ϊ1.6mol��
2NO(g)+2CO(g)N2(g)+2CO2(g)
��ʼ��(mol)2.4 2.4 0 0
�仯��(mol) 0.8 0.8 0.4 0.8
ƽ����(mol)1.61.6 0.4/span> 0.4
0��20minƽ����Ӧ����v(NO)= =0.01 molL-1min-1���ʴ�Ϊ��0.01��
=0.01 molL-1min-1���ʴ�Ϊ��0.01��
��K= =
=![]() ����Ӧ��ƽ������������м���0.4molCO��0.4molCO2����ʱQc=
����Ӧ��ƽ������������м���0.4molCO��0.4molCO2����ʱQc=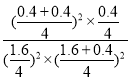 =
=![]() ��K��ƽ�����淴Ӧ�����ƶ����ʴ�Ϊ�����淴Ӧ�����ƶ���
��K��ƽ�����淴Ӧ�����ƶ����ʴ�Ϊ�����淴Ӧ�����ƶ���
����t2ʱ�̣����������ݻ�Ѹ������ԭ����2������С��ѹǿ�������淴Ӧ���ʾ��Ǽ�С�ģ�ƽ�����淴Ӧ�����ƶ���t3ʱ�̴ﵽ�µ�ƽ��״̬�����Դ�t2��t4ʱ������Ӧ������ʱ��ı仯���� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(3)�ڶ�����HCNO��NO2��Ӧ���ѵ�Ԫ�غ�̼Ԫ��ת���������Ϊ�����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��8HNCO+6NO2![]() 7N2+8CO2+4H2O���ʴ�Ϊ��8HNCO+6NO2
7N2+8CO2+4H2O���ʴ�Ϊ��8HNCO+6NO2![]() 7N2+8CO2+4H2O��
7N2+8CO2+4H2O��
(4)�����£���x mol��L��1��ˮ�м���������y mol��L��1����û����ҺMǡ�������ԣ���Һ�����ԣ�c(H+)=c(OH-)������غ�ã�c(NH4+)+c(H+)=2c(SO42-)+c(OH-)������c(NH4+)=2c(SO42-)�����M��Һ����������Ũ���ɴ�С��˳��Ϊc(NH4+)��c(SO42-)��c(H+)=c(OH-)���ʴ�Ϊ��c(NH4+)��c(SO42-)��c(H+)=c(OH-)��
�ڽ�x molL-1�İ�ˮ��ymolL-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c(OH-)=1��10-7mol/L����Һ��c(NH4+)=2c(SO42-)=ymol/L����Ϻ�Ӧǰc(NH3H2O)=![]() mol/L����Ӧ��c(NH3H2O)=(
mol/L����Ӧ��c(NH3H2O)=(![]() -y)mol/L����K=
-y)mol/L����K=![]() =
=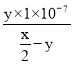 =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��