题目内容
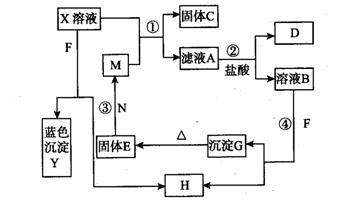
 已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).请回答下列问题;
(1)E的化学式为
Fe2O3
Fe2O3
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是:
铁丝上附有红色物质,溶液颜色逐渐变为浅绿色
铁丝上附有红色物质,溶液颜色逐渐变为浅绿色
.(3)反应①②③④中属于置换反应的是
①③
①③
(填序号).(4)反应②的离子方程式为
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)用石墨作电极电解500mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g.
请回答下列问题:
①写出电解时的阳极反应式
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
②电解一段时间后转移
0.05
0.05
mol电子,溶液的pH降低
降低
(填“升高”、“不变”、“降低”)分析:X为中学化学中一种常见的盐,F为淡黄色固体,与X溶液反应生成蓝色沉淀Y为氢氧化铜可知,F为Na2O2;X溶液中含铜离子;M、N为常见的金属,结合N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器,E和N反应生成M可知发生了置换反应,判断N为Al,E为Fe2O3;M为Fe,结合M和含铜离子的X溶液反应生成固体C为铜,滤液A为亚铁盐溶液,加入盐酸会发生反应生成无色气体D,说明A只能是硝酸亚铁,即X溶液为硝酸铜溶液;F为过氧化钠加入到溶液B中生成H为气体单质氧气,D为无色气体一氧化氮,D在空气中会出现红棕色二氧化氮;
解答:解:X为中学化学中一种常见的盐,F为淡黄色固体,与X溶液反应生成蓝色沉淀Y为氢氧化铜可知,F为Na2O2;X溶液中含铜离子;M、N为常见的金属,结合N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器,E和N反应生成M可知发生了置换反应,判断N为Al,E为Fe2O3;M为Fe,结合M和含铜离子的X溶液反应生成固体C为铜,滤液A为亚铁盐溶液,加入盐酸会发生反应生成无色气体D,说明A只能是硝酸亚铁,即X溶液为硝酸铜溶液;F为过氧化钠加入到溶液B中生成H为气体单质氧气,D为无色气体一氧化氮,D在空气中会出现红棕色二氧化氮;综上所述:A、Fe(NO3)2;B、Fe(NO3)3;C、Cu;D、NO;E、Fe2O3;F、Na2O2;G、Fe(OH)3;H、O2;M、Fe;N、Al;X、Cu(NO3)2;Y、Cu(OH)2;根据判断出的物质分析回答问题:
(1)依据上述推断E为:Fe2O3,故答案为:Fe2O3
(2)将M丝插入盛有X溶液的试管中,是Fe和硝酸铜溶液反应生成铜和硝酸亚铁,反应一段时间后的现象,铁丝上附有红色物质,溶液颜色逐渐变为浅绿色;故答案为:铁丝上附有红色物质,溶液颜色逐渐变为浅绿色;
(3)反应①是铁和硝酸铜溶液反应发生置换反应;②是硝酸亚铁和盐酸发生氧化还原反应;③是氧化铝和铁反应生成铝和氧化铁,是置换反应;④是硝酸铁和过氧化钠反应,不是置换反应,所以中属于置换反应的是①③,故答案为:①③;
(4)反应②是亚铁离子在硝酸溶液中发生的氧化还原反应,离子方程式为:反应②的离子方程式反应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)用石墨作电极电解500mL Cu(NO3)2溶液,观察到A电极表面有红色的固态物质Cu生成,B电极有无色气体O2生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g为铜,物质的量为0.025mol;
①阳极电极反应是氢氧根离子放电,电极反应为:4OH--4e-=O2↑+2H2O;
②阳极电极反应为4OH--4e-=O2↑+2H2O;阴极电极反应为:Cu2++2e-=Cu;析出铜0.025mol,电子转移为0.05mol;电解过程中氢氧根离子减少生成氢离子,所以溶液PH降低;
故答案为:0.05; 降低;
(1)依据上述推断E为:Fe2O3,故答案为:Fe2O3
(2)将M丝插入盛有X溶液的试管中,是Fe和硝酸铜溶液反应生成铜和硝酸亚铁,反应一段时间后的现象,铁丝上附有红色物质,溶液颜色逐渐变为浅绿色;故答案为:铁丝上附有红色物质,溶液颜色逐渐变为浅绿色;
(3)反应①是铁和硝酸铜溶液反应发生置换反应;②是硝酸亚铁和盐酸发生氧化还原反应;③是氧化铝和铁反应生成铝和氧化铁,是置换反应;④是硝酸铁和过氧化钠反应,不是置换反应,所以中属于置换反应的是①③,故答案为:①③;
(4)反应②是亚铁离子在硝酸溶液中发生的氧化还原反应,离子方程式为:反应②的离子方程式反应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)用石墨作电极电解500mL Cu(NO3)2溶液,观察到A电极表面有红色的固态物质Cu生成,B电极有无色气体O2生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g为铜,物质的量为0.025mol;
①阳极电极反应是氢氧根离子放电,电极反应为:4OH--4e-=O2↑+2H2O;
②阳极电极反应为4OH--4e-=O2↑+2H2O;阴极电极反应为:Cu2++2e-=Cu;析出铜0.025mol,电子转移为0.05mol;电解过程中氢氧根离子减少生成氢离子,所以溶液PH降低;
故答案为:0.05; 降低;
点评:本题考查了无机化合物的转化关系和性质应用,主要考查物质性质的综合应用,转化关系的反应产物判断,置换反应的判断,氧化还原反应的离子方程式书写,电解电解反应和电解计算.

练习册系列答案
相关题目
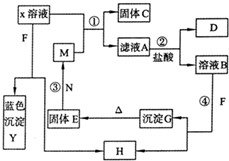 (2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).
(2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).