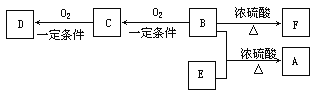
��Ŀ����
����Ŀ���㶹������;�㷺�����ϣ��ϳ��㶹�ص�·�������������Լ������P��Ӧ������ʡ������

��1����ķ���ʽΪ_____________��
��2����Ӧ���ķ�Ӧ������_____________����Ӧ�ܵķ�Ӧ������_____________��
��3��д����Ӧ���Ļ�ѧ��Ӧ����ʽ____________ _________��
��4���㶹���ڹ���NaOH��Һ����ȫˮ��Ļ�ѧ����ʽΪ_____________________��
��5�����Ǣ���ͬ���칹�壬���ķ����к��б�������̼̼˫���������Ϻ���������λȡ�������ܷ���������Ӧ�����Ľṹ��ʽΪ_______________����д��������
��6��һ�������£�![]() ��CH3CHO�ܷ������Ʒ�Ӧ�١��ڵ�������Ӧ���������ɵ��л���Ľṹ��ʽΪ ��
��CH3CHO�ܷ������Ʒ�Ӧ�١��ڵ�������Ӧ���������ɵ��л���Ľṹ��ʽΪ ��
���𰸡���1��C7H6O2 ��2���ӳ���Ӧ��������Ӧ
��3��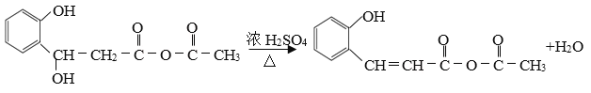
��4�� 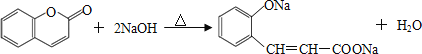
��5������д���֣�����������Ҳ������

��6��![]()
��������
�����������1�������л���Ľṹ��ʽ��֪����ķ���ʽΪC7H6O2��
��2������I�����Ľṹ��ʽ��֪����Ӧ��ȩ����Ϊ�ǻ�������ȩ���ļӳɷ�Ӧ�����к����ǻ����Ȼ������Ը����㶹�صĽṹ��ʽ��֪���÷�Ӧ�Ƿ����ڵ�������Ӧ��
��3�������������Ľṹ��ʽ��֪�����д��ǻ���������ʧ��ͬʱ������̼̼˫����˵���Ǵ�����ȥ��Ӧ����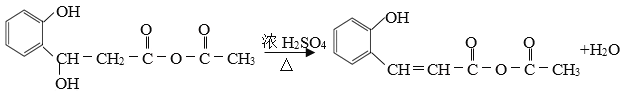 ��
��
��4���㶹���к�����������ˮ����ֲ���1�����ǻ��������㶹�غ�����������Һ��Ӧ����2mol�������ƣ����㶹���ڹ���NaOH��Һ����ȫˮ��Ļ�ѧ����ʽΪ
 ��
��
��5���ܷ���������Ӧ��˵������ȩ�������Ը��������ṹ��ʽ��֪����ͬ���칹���е���һ�����������Ȼ�������������Ϊȡ����������λ����������ܵĽṹ��ʽ�ֱ���
 ��
��
��6��������֪����Ϣ��֪���÷�Ӧ��ȩ���ļӳɷ�Ӧ�����Է�Ӧ����������ṹ��ʽ��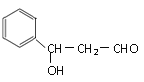 ���������������Ľṹ��ʽ��
���������������Ľṹ��ʽ��![]() ��
��

����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿɳ�Ϊȼ�ϡ���ҵ�����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��CO2(g)+3H2(g)![]() CH3OH��g��+H2O(g) ��H����58 kJ/mol
CH3OH��g��+H2O(g) ��H����58 kJ/mol
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H����41 kJ/mol
CO(g)+H2O(g) ��H����41 kJ/mol
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C | H��O | C��H |
E/��kJ.mol-1�� | 436 | 343 | 1076 | 465 | x |
��x��_________��
��2����T��ʱ��6molCO2��8molH2����2L�ܱ������з�����Ӧ�ڣ����H2�����ʵ�����ʱ��仯��ͼ��״̬��(ͼ��ʵ��)��ʾ��ͼ������A(1��6)������1minʱH2�����ʵ�����6mol��

��T��ʱ״̬�������£�0��3min��CH3OH��ƽ����Ӧ����v��_____________mol/(L��min)��ƽ�ⳣ��K��____��
��������������ʱ�����ı�ijһ��������H2�����ʵ�����ʱ��仯��ͼ��״̬����ʾ����ı������������_______��
�������������䣬���ı��¶�ʱ�����H2�����ʵ�����ʱ��仯��ͼ��״̬����ʾ����״̬����Ӧ���¶�________(������������������=��)T�棻
����״̬����ƽ�ⳣ��ΪK2��״̬����ƽ�ⳣ��ΪK3����K2____(����������������������)K3��
��һ���¶��£��˷�Ӧ�ں��������н��У����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���ݵ���_____��
a��������ѹǿ���� b���״���ˮ����������ȱ��ֲ���
c��v����H2����3v�棨CH3OH�� d��2��C��O���ѵ�ͬʱ��6��H��H����
����Ŀ��(15��)��Ҫ��ش������й����⡣
��1���ݱ�������ѧ�����з���һ�ֳ����´��ϳ�NH3�ķ�����2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
��֪������Ϣ��
��������������ȿ��Ա�ʾ�������������ѧ�ϣ��涨��״�����ȶ����ʵ�������Ϊ0���������ʵ������ȣ�NH3(g)ΪmkJ��mol-1��H2O(l)ΪnkJ��mol-1��
��Ӧ����H=�����������֮��---��Ӧ���������֮��
�����ֻ�ѧ���ļ����������£�
![]()
������Ӧ�У���H=_______kJ��mol-1��H-N���ļ���Ϊ_______kJ��mol-1��
��2������������һ�������¿��Է������·�Ӧ��
SO2(g)+NO2(g)![]() SO3(g)+NO(g)����H= -42kJ��mol-1����1L�����ܱ������г���SO2(g)��NO2(g)������ʵ���������£�
SO3(g)+NO(g)����H= -42kJ��mol-1����1L�����ܱ������г���SO2(g)��NO2(g)������ʵ���������£�
ʵ���� | �¶� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
N(SO2) | N(NO2) | N(NO) | ||
�� | T1 | 0.80 | 0.20 | 0.18 |
�� | T2 | 0.20 | 0.80 | 0.16 |
�� | T3 | 0.20 | 0.30 | a |
��ʵ����У���2minʱ��÷ų���������4.2kJ����0~2minʱ���ڣ���SO2(g)��ʾ��ƽ����Ӧ����v(SO2)=_____________________��
��ʵ����У��ﵽƽ��ʱ��NO2��ת����Ϊ____________��
���ɱ������ݿ���֪��Tl______T2(���������������=��)��
��3���Է�ӦN2O4(g)![]() 2NO2(g) ��H��0 ���¶�ΪTl��T2ʱƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����__________��
2NO2(g) ��H��0 ���¶�ΪTl��T2ʱƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����__________��

a��A��C����ķ�Ӧ���ʣ�A��C
b��A��C�����������ɫ��A�Cdz
c����״̬A��״̬B�������ü��ȵķ���
d��A��C����Ļ�ѧƽ�ⳣ����A=C
��4����ҵ�ϣ�����ʯī��������Ϊ�缫������ȥ��ˮ�е�CN-(NΪ-3�ۣ���ͬ)

�����缫Ӧ����ֱ����Դ��____________(��д�缫����)��
��������Ӧ����ʽ��ƽ������Ӧ��д________��
�������Ϸ����ĵ缫��ӦΪ2Cl--2e-=Cl2����_______________��
����Ŀ��(NH4)2Fe(SO4)2��6H2O(Ī���Σ�dz��ɫ��ʽ��392)�ڶ��������г������궨������ء��ظ���ص���Һ�ı����ʣ���������ѧ�Լ���ҽҩ�Լ�����ұ�𡢵�Ƶȡ�
�ش�����������
��1��Ī�����ڿ����б����������ȶ���������¶���ڿ�����Ҳ�����������Ī�����Ƿ���ʵ��Լ���_______________��
��2��ȷ��ȡmg������Ī���Σ�����ƿ�м���20mLˮ����ܽ⣬��ij����K2Cr2O7��Һ�ζ����յ㡣�ظ�����3�Σ�����й�����������
ʵ����� | ��ʼ����/mL | �յ����/mL |
I | 2.50 | 22.58 |
�� | 1.00 | 23.12 |
�� | 0.00 | 19.92 |
��K2Cr2O7��ҺӦ�÷���______________ʽ�ζ����С�
��д���ζ������з�Ӧ�����ӷ���ʽ��______________��
������K2Cr2O7��Һ�����ʵ���Ũ��Ϊ______________mol/L(�ú�M�Ĵ���ʽ��ʾ)��
��3��ij������ͨ��ʵ�����Ī���ξ������ʱ�ķֽ���
����ͬѧ����������ֽ���������N2��Fe2O3��SO3��H2O�������ʡ����Ƿ�ͬ�Ⲣ˵��������______________��
����ͬѧ�������ͼװ�ã�����Aװ���еĹ����Ϊ����ɫ�����������к���______________��Cװ���к�ɫ��ȥ��˵����������к���______________��

Cװ�ú�Ӧ����β������װ��D��D��ʢ�е��Լ�������______________(дһ�ּ���)��
����ͬѧ����������װ��֤���ֽ�����к��а���.ֻ�����B��C�е��Լ����ɣ����������Լ�ΪB______________��C______________��
����ͬѧ��ΪĪ���ηֽ���ܻ�����N2��SO3���������װ����ѡ���Ҫ��װ�ü���֤��������ȷ������˳�������������A��______________��