��Ŀ����
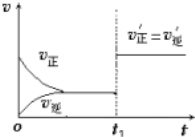
����Ŀ���ڿ��淴ӦN2+3H2==2NH3�У������������������£������¶�ƽ��������Ӧ�����ƶ���Ϊ ________ ��Ӧ��ѡ����ȡ��������ȡ�������ͼΪ��Ӧ���ʣ��ͣ���ʱ�䣨t����ϵ��ʾ��ͼ����ͼ�жϣ���t1ʱ�����߷����仯��ԭ���� _________ ����д��ţ���
a������N2��Ũ��
b�������������
c���������
d�������¶�
�ı�������ƽ��������NH3�İٷֺ��� ______ ��ѡ���������С���������䡱����
���𰸡� ���� c ����
�����������������������Ҫ���黯ѧƽ�⡣
�����¶�ƽ��������Ӧ�����ƶ���Ϊ���ȷ�Ӧ����t1ʱ������Ӧ�������淴Ӧ����ͬ�ȳ̶��������߷����仯��ԭ���� c��������Ӱ�컯ѧƽ�⣬�ı�������ƽ��������NH3�İٷֺ������䡣

����Ŀ����������V���㷺Ӧ���ں��ա���������Դ����ҵ��
��1����Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ__________��3d �ܼ��ϵ�δ�ɶԵ�����Ϊ___________��
��2��VCl2��Һ���Ҷ���(H2N��CH2��CH3��NH4 )���γ�������[V(En)2]2+ (En���Ҷ����ļ�д)�����������������ǽ���Ԫ�صĵ縺���ɴ�С��˳����___________ (��Ԫ�ط��ű�ʾ)���Ҷ��������е�ԭ�ӵ��ӻ��������Ϊ_____________���Ҷ��������װ�[N(CH3)3]�����ڰ�������Է���������������Ҷ��������װ��ķе�ߵö࣬ԭ����______________��
��3��LiVH4��һ������Ļ�ԭ�����ɽ�����ֱ�ӻ�ԭ���Ҵ���CH3COOH��CH3CH2OH�����ЦҼ���Ŀ֮��Ϊ ____________��
��4�������γɶ�������������������� X��Y�Ļ�ѧʽ��Ϊ V(NH3)3ClSO4��ȡX��Y����Һ��������ʵ��(��֪�����ѵ������)��
X | X | Y | Y | |
�Լ� | BaCl2��Һ | AgNO3��Һ | BaCl2��Һ | AgNO3��Һ |
���� | ��ɫ���� | �����Ա仯 | �����Ա仯 | ��ɫ���� |
�� X��������Ϊ___________��Y�������� __________��
��5��VO����ľ����ṹ��ͼ��ʾ��VO������ V2+����λ��Ϊ __________________�����þ����߳�Ϊ b nm����þ�����ܶ�Ϊ__________ (�ú� b��NA�Ĵ���ʽ��ʾ)g��cm-3��