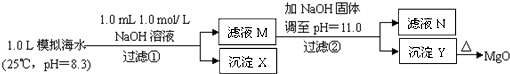
题目内容
已知:Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12;溶液中某种离子的浓度小于1.0×10-5mol?L-1,可认为该离子不存在.现有1L含有Mg2+、Ca2+分别为0.05mol和0.001mol的某溶液,向其中加入4.2g NaOH固体,充分反应后过滤得到滤液M和沉淀N.下列说法不正确的是( )
分析:c(OH-)=
=0.105mol/L,
A.Ca(OH)2和Mg(OH)2组成相似,溶度积越小,越易生成沉淀;
B.根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算;
C.根据Mg2+、Ca2+的物质的量结合溶度积判断反应的程度;
D.溶液中含有较多的钙离子,溶液会变浑浊,应生成Ca(OH)2沉淀.
| ||
| 1L |
A.Ca(OH)2和Mg(OH)2组成相似,溶度积越小,越易生成沉淀;
B.根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算;
C.根据Mg2+、Ca2+的物质的量结合溶度积判断反应的程度;
D.溶液中含有较多的钙离子,溶液会变浑浊,应生成Ca(OH)2沉淀.
解答:解:c(OH-)=
=0.105mol/L,
A.Ca(OH)2和Mg(OH)2组成相似,溶度积的计算公式类似,则溶度积越小,越易生成沉淀,故A正确;
B.首先发生Mg2++2OH-=Mg(OH)2↓,反应后剩余c(OH-)=0.105mol/L-0.1mol/L=0.005mol/L,则Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.61×10-12,
可解得c(Mg2+)=
=0.2244×10-6mol?L-1<1.0×10-5mol?L-1,则无Mg2+剩余,故B正确;
C.反应后剩余c(OH-)=0.105mol/L-0.1mol/L=0.005mol/L,则c(Ca2+)×c2(OH-)=0.001×0.0052=2.5×10-8<Ksp[Ca(OH)2],没有Ca(OH)2生成,故C错误;
D.继续向M中加入NaOH溶液,溶液中含有较多的钙离子,溶液会变浑浊,应生成Ca(OH)2沉淀,故D正确.
故选C.
| ||
| 1L |
A.Ca(OH)2和Mg(OH)2组成相似,溶度积的计算公式类似,则溶度积越小,越易生成沉淀,故A正确;
B.首先发生Mg2++2OH-=Mg(OH)2↓,反应后剩余c(OH-)=0.105mol/L-0.1mol/L=0.005mol/L,则Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.61×10-12,
可解得c(Mg2+)=
| 5.61×10-12 |
| 0.0052 |
C.反应后剩余c(OH-)=0.105mol/L-0.1mol/L=0.005mol/L,则c(Ca2+)×c2(OH-)=0.001×0.0052=2.5×10-8<Ksp[Ca(OH)2],没有Ca(OH)2生成,故C错误;
D.继续向M中加入NaOH溶液,溶液中含有较多的钙离子,溶液会变浑浊,应生成Ca(OH)2沉淀,故D正确.
故选C.
点评:本题考查难溶电解质的溶解平衡以及转化等知识,题目难度中等,注意根据溶度积常数计算并进行判断,答题中注意梳理做题思路.

练习册系列答案
相关题目