题目内容
3.设 NA 为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为 1.5NA | |
| B. | 常温常压下,7.0 g 乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 50mL l8.4 mol/L 浓硫酸与足量铜微热反应,生成 SO2分子的数目为 0.46NA | |
| D. | 某密闭容器盛有0.lmolN2和0.3molH2,在一定条件下充分反应,转移电子的数 目为 0.6NA |
分析 A、标况下HF为液体;
B、乙烯和丙烯的最简式均为CH2;
C、铜只能和浓硫酸反应,和稀硫酸不反应;
D、合成氨的反应为可逆反应.
解答 解:A、标况下HF为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、乙烯和丙烯的最简式均为CH2,故7g混合物中含有的CH2的物质的量为0.5mol,故含H原子为NA个,故B正确;
C、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,故生成的二氧化硫分子个数小于0.46NA个,故C错误;
D、合成氨的反应为可逆反应,不能进行完全,故转移的电子数小于0.6NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列有机反应属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HBr→CH3CH2Br | ||
| C. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ +H2O +H2O | D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
1.下列措施能加快化学反应速率的是( )
| A. | 将食物放入冰箱 | B. | 向炉膛鼓风 | ||
| C. | 钨丝灯泡中抽成近真空 | D. | 食物袋中放入小包除氧剂 |
18.下列物质中,不溶于水的是( )
| A. | 苯 | B. | 乙醇 | C. | 乙酸 | D. | 蔗糖 |
5.如图,将铁棒和碳棒用导线连接后插入稀硫酸中,构成原电池.下列叙述不正确的是( )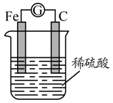

| A. | 电子从碳棒经导线流向铁棒 | B. | 铁棒是负极,碳棒是正极 | ||
| C. | 电池反应为:Fe+2H+=Fe2++H2↑ | D. | 碳棒上有气体放出,溶液c(H+)减小 |
8.下列各组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是( )
| A. | 食盐和氯化氢溶于水 | B. | 硅和冰熔化 | ||
| C. | 碘和干冰升华 | D. | 二氧化硅和氧化钠熔化 |
12.共价键、离子键、氢键和范德华力是构成物质微粒间的不同作用力,下列物质中只含有上述一种作用力的是( )
| A. | 干冰 | B. | 氖气 | C. | 氢氧化钠 | D. | 碘 |

 ,反应类型是加聚反应.
,反应类型是加聚反应.