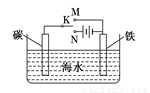
题目内容
下图是另一种元素周期表——三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是

A.Q、T两元素的氢化物的稳定性为HnT<HnQ
B.L、R的单质与盐酸反应速率为R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
练习册系列答案
相关题目
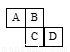
4种短周期元素在周期表中的相对位置如图所示,Y元素原子最外层电子数是其电子层数的3倍。下列说法中,正确的是
X | Y | |
Z | W |
A. X的氢化物可用作制冷剂
B. Y与氢元素形成的物质中只含有极性共价键
C. 4种元素的原子半径最大的是W
D. 4种元素中Z的最高价氧化物对应水化物的酸性最强
(12分)图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
元素编号 | A | B | C | D | E |
电负性 | 3.0 | 2.5 | X[ | 1.5 | 0.9 |
原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
请回答下列问题:
(1)写出E元素的离子结构示意图 ;
(2)X的值应为 (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系 ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是: (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式: