题目内容
【题目】N、P、As、Ga、Cr、Cu等元素化合物种类繁多,具有重要的研究价值和应用价值。请回答下列问题:
(1)Cr元素价电子排布式为__________________。
(2)N2F2分子中,氮原子的杂化轨道类型为_______,画出N2F2可能的结构式_____。
(3)PCl3和PCl5是磷元素形成的两种重要化合物,请根据价电子互斥理论推测PCl3的空间构型__________________。
(4)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构,性能比硅更优良。广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中。
①砷化镓属于____晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是___(填化学式),其理由是____。上述两种晶体中的四种元素电负性最小的是_____(填元素符号)。
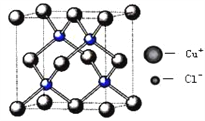
(5)铜的化合物种类很多,下图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氢化亚铜密度的计算式为ρ=_______g/cm3.(用NA表示阿佛加德罗常数)
【答案】 3d54s1 sp2 ![]() 或
或![]() 三角锥形 原子晶体 BN 二者均为原子晶体,B、N间的键长比Ga、As的键长短,键能大 Ga
三角锥形 原子晶体 BN 二者均为原子晶体,B、N间的键长比Ga、As的键长短,键能大 Ga ![]()
【解析】(1)Cr的原子序数为24,电子排布为 1s2 2s2 2p6 3s2 3p6 3d5 4s1,价电子排布式为3d54s1 ;正确答案:3d54s1。
(2)N2F2分子中,氮原子形成了3个σ键和2个π键,则其杂化轨道类型为sp2; N2F2可能的结构式:![]() 或
或![]() ;正确答案:sp2 ;
;正确答案:sp2 ; ![]() 或
或![]() 。
。
(3)磷原子最外层有5个电子,三个电子分别和氯原子形成三对共用电子对,另有一对孤对电子,根据价电子互斥理论推测PCl3的空间构型为三角锥形;正确答案:三角锥形。
(4)砷化镓是具有空间网状结构的晶体,熔点为1230℃,它为原子晶体,已知氮化硼与砷化镓属于同种晶体都属于原子晶体,B-N键长比Ga-As的键长短,键能大,故氮化硼晶体熔点较高,非金属性越强,电负性越强,则B、N、Ga、As四种元素电负性最小的Ga;正确答案:原子晶体;BN ; 二者均为原子晶体,B、N间的键长比Ga、As的键长短,键能大;Ga。
(5)氯化亚铜密度计算公式:ρ×V×NA=N×M, 氯化亚铜摩尔质量(M)为99.5g/mol,根据晶胞图可知:铜原子有:8×1/8+6×1/2=4,氯原子有:4个;所以该晶胞中含有4个氯化亚铜,N=4,已知晶胞的棱长为a cm,体积为V=a3,带入上述公式得ρ=![]() g/cm3;正确答案:
g/cm3;正确答案:![]() 。
。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案



